Bioquímica del dolor:Todos los síndromes de dolor tienen un perfil de inflamación. Un perfil inflamatorio puede variar de persona a persona y también puede variar en una persona en diferentes momentos. El tratamiento de los síndromes de dolor consiste en comprender este perfil de inflamación. Los síndromes de dolor se tratan con medicamentos, cirugía o ambos. El objetivo es inhibir / suprimir la producción de mediadores inflamatorios. Y un resultado exitoso es aquel que produce menos inflamación y, por supuesto, menos dolor.
Contenido
Bioquímica del dolor
Objetivos:
- ¿Quiénes son los jugadores clave?
- ¿Cuáles son los mecanismos bioquímicos?
- ¿Cuáles son las consecuencias?
Revisión de inflamación:
Actores clave
 ¿Por qué me duele el hombro? Una revisión de la base neuroanatómica y bioquímica del dolor de hombro
¿Por qué me duele el hombro? Una revisión de la base neuroanatómica y bioquímica del dolor de hombro
RESUMEN
Si un paciente pregunta `` ¿por qué me duele el hombro? '', La conversación se convertirá rápidamente en teoría científica y, a veces, en conjeturas sin fundamento. Con frecuencia, el médico se da cuenta de los límites de la base científica de su explicación, lo que demuestra lo incompleto de nuestra comprensión de la naturaleza del dolor de hombro. Esta revisión adopta un enfoque sistemático para ayudar a responder preguntas fundamentales relacionadas con el dolor de hombro, con miras a proporcionar información sobre investigaciones futuras y métodos novedosos para tratar el dolor de hombro. Exploraremos las funciones de (1) los receptores periféricos, (2) el procesamiento del dolor periférico o la `` nocicepción '', (3) la médula espinal, (4) el cerebro, (5) la ubicación de los receptores en el hombro y (6) ) la anatomía neural del hombro. También consideramos cómo estos factores pueden contribuir a la variabilidad en la presentación clínica, el diagnóstico y el tratamiento del dolor de hombro. De esta manera, nuestro objetivo es proporcionar una descripción general de los componentes del sistema de detección de dolor periférico y los mecanismos centrales de procesamiento del dolor en el dolor de hombro que interactúan para producir dolor clínico.
INTRODUCCIÓN: UNA MUY BREVE HISTORIA DE LA CIENCIA DEL DOLOR ESENCIAL PARA LOS CLÍNICOS
La naturaleza del dolor, en general, ha sido objeto de mucha controversia durante el siglo pasado. En el siglo XVII, la teoría de Descartes17 propuso que la intensidad del dolor estaba directamente relacionada con la cantidad de lesión tisular asociada y que el dolor se procesaba en una vía distinta. Muchas teorías anteriores se basaban en esta filosofía descartiana llamada `` dualista '', considerando el dolor como la consecuencia de la estimulación de un receptor de dolor periférico `` específico '' en el cerebro. En el siglo XX se produjo una batalla científica entre dos teorías opuestas, a saber, la teoría de la especificidad y la teoría de patrones. La `` teoría de la especificidad '' descartiana vio el dolor como una modalidad separada específica de información sensorial con su propio aparato, mientras que la `` teoría del patrón '' consideró que el dolor era el resultado de la estimulación intensa de receptores no específicos.1 En 20, Wall y Melzack 2 La teoría de la puerta del dolor proporcionó evidencia para un modelo en el que la percepción del dolor estaba modulada tanto por la retroalimentación sensorial como por el sistema nervioso central. Otro gran avance en la teoría del dolor, aproximadamente al mismo tiempo, vio el descubrimiento del modo específico de acción de los opioides.1965 Posteriormente, los avances recientes en neuroimagen y medicina molecular han ampliado enormemente nuestra comprensión general del dolor.
Entonces, ¿cómo se relaciona esto con el dolor de hombro?El dolor en el hombro es un problema clínico común, y una sólida comprensión de la forma en que el cuerpo procesa el dolor es esencial para diagnosticar y tratar mejor el dolor de un paciente. Los avances en nuestro conocimiento del procesamiento del dolor prometen explicar el desajuste entre la patología y la percepción del dolor; también pueden ayudarnos a explicar por qué ciertos pacientes no responden a ciertos tratamientos.
BLOQUES BÁSICOS DE CONSTRUCCIÓN DEL DOLOR
Receptores sensoriales periféricos: el mecanorreceptor y el nociceptor
Existen numerosos tipos de receptores sensoriales periféricos presentes en el sistema musculoesquelético humano. 5 Se pueden clasificar en función de su función (como mecanorreceptores, termorreceptores o nociceptores) o morfología (terminaciones nerviosas libres o diferentes tipos de receptores encapsulados) .5 Los diferentes tipos de receptores pueden luego subclasificarse aún más en función de la presencia de ciertos marcadores químicos. Existen superposiciones significativas entre diferentes clases funcionales de receptores, por ejemplo
Procesamiento del dolor periférico: Nocicepción
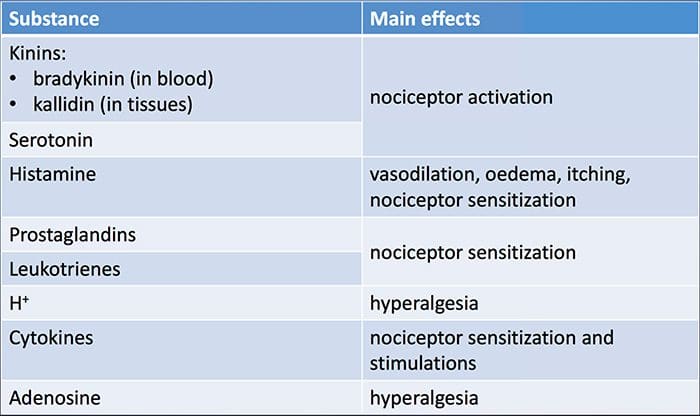
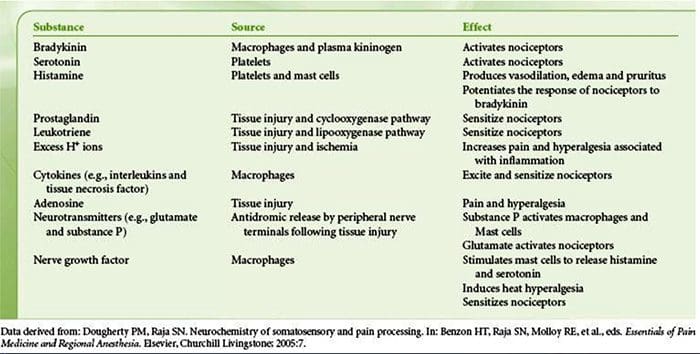
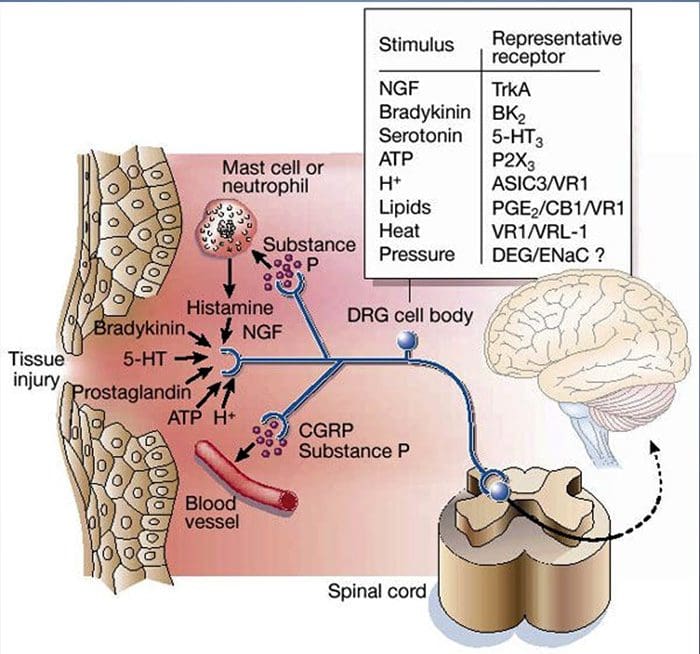
La lesión tisular implica la liberación de una variedad de mediadores inflamatorios por las células dañadas, como bradicinina, histamina, 5-hidroxitriptamina, ATP, óxido nítrico y ciertos iones (K + y H +). La activación de la vía del ácido araquidónico conduce a la producción de prostaglandinas, tromboxanos y leuco- trienos. Las citocinas, incluidas las interleucinas y el factor de necrosis tumoral \ alpha, y las neurotrofinas, como el factor de crecimiento nervioso (NGF), también se liberan y están íntimamente involucradas en la facilitación de la inflamación.15 Otras sustancias como los aminoácidos excitadores (glutamato) y los opioides ( endotelina-1) también han sido implicados en la respuesta inflamatoria aguda.16 17 Algunos de estos agentes pueden activar directamente nociceptores, mientras que otros provocan el reclutamiento de otras células que luego liberan agentes facilitadores adicionales.18 Este proceso local resulta en una mayor capacidad de respuesta de neuronas nociceptivas a su entrada normal y / o el reclutamiento de una respuesta a entradas normalmente subumbrales se denomina `` sensibilización periférica ''. La figura 1 resume algunos de los mecanismos clave involucrados.
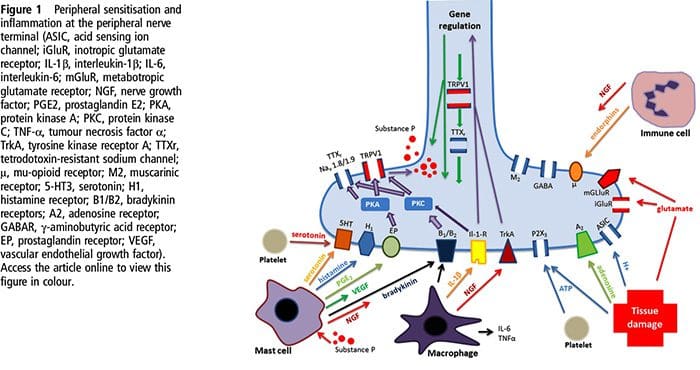 El NGF y el receptor del miembro 1 de la subfamilia V del canal catiónico potencial del receptor transitorio (TRPV1) tienen una relación simbiótica cuando se trata de inflamación y sensibilización de nociceptores. Las citocinas producidas en el tejido inflamado dan como resultado un aumento en la producción de NGF.19 El NGF estimula la liberación de histamina y serotonina (5-HT3) por los mastocitos y también sensibiliza a los nociceptores, posiblemente alterando las propiedades de A? fibras de modo que una mayor proporción se vuelva nociceptiva. El receptor TRPV1 está presente en una subpoblación de fibras aferentes primarias y es activado por capsaicina, calor y protones. El receptor TRPV1 se sintetiza en el cuerpo celular de la fibra aferente y se transporta tanto a los terminales periféricos como centrales, donde contribuye a la sensibilidad de los aferentes nociceptivos. La inflamación da como resultado la producción de NGF periféricamente, que luego se une al receptor de tirosina quinasa tipo 1 en las terminales del nociceptor, luego el NGF se transporta al cuerpo celular donde conduce a una regulación positiva de la transcripción de TRPV1 y, en consecuencia, aumenta la sensibilidad del nociceptor19. otros mediadores inflamatorios también sensibilizan a TRPV20 a través de una amplia gama de vías de mensajería secundaria. También se cree que muchos otros receptores, incluidos los receptores colinérgicos, los receptores del ácido \ beta - aminobutírico (GABA) y los receptores de somatostatina, están implicados en la sensibilidad de los nociceptores periféricos.
El NGF y el receptor del miembro 1 de la subfamilia V del canal catiónico potencial del receptor transitorio (TRPV1) tienen una relación simbiótica cuando se trata de inflamación y sensibilización de nociceptores. Las citocinas producidas en el tejido inflamado dan como resultado un aumento en la producción de NGF.19 El NGF estimula la liberación de histamina y serotonina (5-HT3) por los mastocitos y también sensibiliza a los nociceptores, posiblemente alterando las propiedades de A? fibras de modo que una mayor proporción se vuelva nociceptiva. El receptor TRPV1 está presente en una subpoblación de fibras aferentes primarias y es activado por capsaicina, calor y protones. El receptor TRPV1 se sintetiza en el cuerpo celular de la fibra aferente y se transporta tanto a los terminales periféricos como centrales, donde contribuye a la sensibilidad de los aferentes nociceptivos. La inflamación da como resultado la producción de NGF periféricamente, que luego se une al receptor de tirosina quinasa tipo 1 en las terminales del nociceptor, luego el NGF se transporta al cuerpo celular donde conduce a una regulación positiva de la transcripción de TRPV1 y, en consecuencia, aumenta la sensibilidad del nociceptor19. otros mediadores inflamatorios también sensibilizan a TRPV20 a través de una amplia gama de vías de mensajería secundaria. También se cree que muchos otros receptores, incluidos los receptores colinérgicos, los receptores del ácido \ beta - aminobutírico (GABA) y los receptores de somatostatina, están implicados en la sensibilidad de los nociceptores periféricos.
Se ha implicado específicamente a un gran número de mediadores inflamatorios en el dolor de hombro y la enfermedad del manguito rotador.21-25 Si bien algunos mediadores químicos activan directamente los nociceptores, la mayoría provocan cambios en la neurona sensorial misma en lugar de activarla directamente. Estos cambios pueden ser dependientes de la transcripción tardía o postraduccional temprana. Ejemplos de los primeros son los cambios en el receptor TRPV1 o en los canales iónicos dependientes de voltaje que resultan de la fosforilación de proteínas unidas a la membrana. Los ejemplos de este último incluyen el aumento inducido por NGF en la producción del canal TRV1 y la activación de factores de transcripción intracelular inducida por calcio.
Mecanismos moleculares de la nocicepción
La sensación de dolor nos alerta de una lesión real o inminente y desencadena las respuestas protectoras adecuadas. Desafortunadamente, el dolor a menudo sobrevive a su utilidad como sistema de alerta y, en cambio, se vuelve crónico y debilitante. Esta transición a una fase crónica implica cambios dentro de la médula espinal y el cerebro, pero también hay una modulación notable donde se inician los mensajes de dolor a nivel de la neurona sensorial primaria. Los esfuerzos para determinar cómo estas neuronas detectan los estímulos que producen dolor de naturaleza térmica, mecánica o química han revelado nuevos mecanismos de señalización y nos han acercado a la comprensión de los eventos moleculares que facilitan las transiciones del dolor agudo al persistente.
 La neuroquímica de los nociceptores
La neuroquímica de los nociceptores
El glutamato es el neurotransmisor excitador predominante en todos los nociceptores. Sin embargo, los estudios histoquímicos de GRD en adultos revelan dos amplias clases de fibra C amielinada.
Transductores químicos para empeorar el dolor
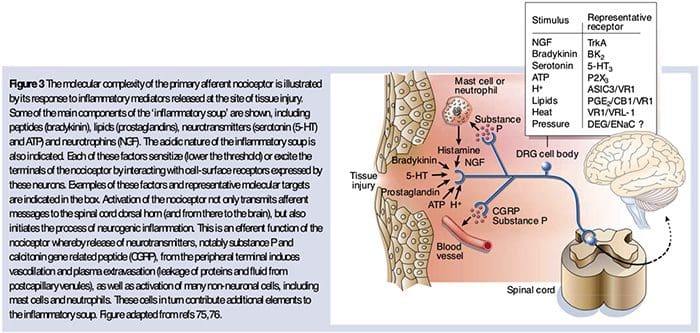
Como se describió anteriormente, la lesión aumenta nuestra experiencia de dolor al aumentar la sensibilidad de los nociceptores a estímulos tanto térmicos como mecánicos. Este fenómeno resulta, en parte, de la producción y liberación de mediadores químicos del terminal sensorial primario y de células no neuronales (por ejemplo, fibroblastos, mastocitos, neutrófilos y plaquetas) en el entorno36 (Fig. 3). Algunos componentes de la sopa inflamatoria (por ejemplo, protones, ATP, serotonina o lípidos) pueden alterar la excitabilidad neuronal directamente interactuando con canales iónicos en la superficie del nociceptores, mientras que otros (por ejemplo, bradiquinina y NGF) se unen a receptores metabotrópicos y mediar sus efectos a través de cascadas de señalización de segundo mensajero11. Se ha logrado un progreso considerable en la comprensión de la base bioquímica de tales mecanismos moduladores.
Protones extracelulares y acidosis tisular
La acidosis tisular local es una respuesta fisiológica característica a la lesión, y el grado de dolor asociado o incomodidad está bien correlacionado con la magnitud de la acidificación 37. La aplicación de ácido (pH 5) a la piel produce descargas sostenidas en un tercio o más de los nociceptores polimodales que inervan el campo receptivo 20.
 Mecanismos celulares y moleculares del dolor
Mecanismos celulares y moleculares del dolor
Resumen
El sistema nervioso detecta e interpreta una amplia gama de estímulos térmicos y mecánicos, así como irritantes químicos ambientales y endógenos. Cuando son intensos, estos estímulos generan dolor agudo, y en el contexto de una lesión persistente, los componentes periféricos y del sistema nervioso central de la vía de transmisión del dolor exhiben una tremenda plasticidad, mejorando las señales del dolor y produciendo hipersensibilidad. Cuando la plasticidad facilita los reflejos protectores, puede ser beneficioso, pero cuando los cambios persisten, puede producirse una afección de dolor crónico. Los estudios genéticos, electrofisiológicos y farmacológicos están elucidando los mecanismos moleculares que subyacen a la detección, codificación y modulación de estímulos nocivos que generan dolor.
Introducción: dolor agudo versus dolor persistente
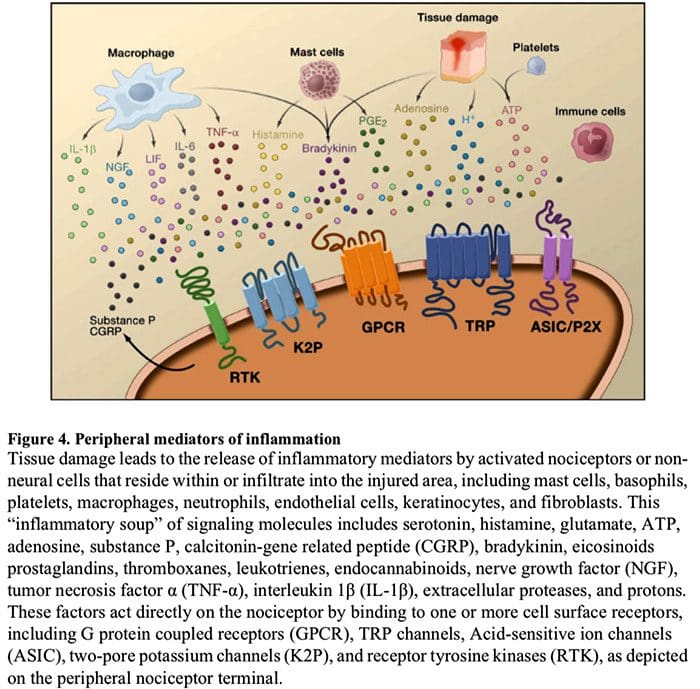
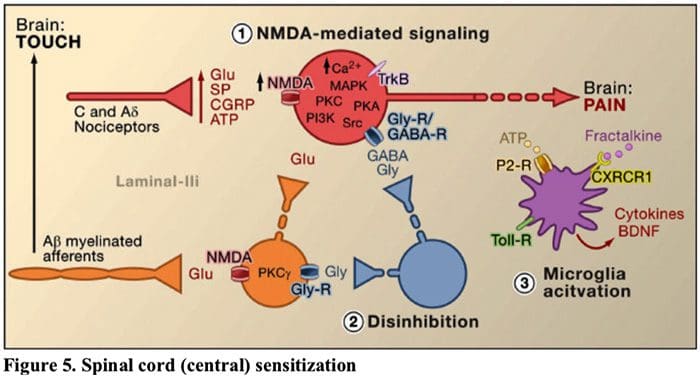 Figura 5. Sensibilización de la médula espinal (central)
Figura 5. Sensibilización de la médula espinal (central)
- Glutamato / sensibilización mediada por el receptor NMDA. Después de una estimulación intensa o una lesión persistente, ¿activaron C y A? Los nociceptores liberan una variedad de neurotransmisores que incluyen dlutamato, sustancia P, péptido relacionado con el gen de la calcitonina (CGRP) y ATP, en las neuronas de salida en la lámina I del asta dorsal superficial (rojo). Como consecuencia, los receptores de glutamato NMDA normalmente silenciosos ubicados en la neurona postsináptica ahora pueden señalar, aumentar el calcio intracelular y activar una serie de vías de señalización dependientes del calcio y segundos mensajeros, incluida la proteína quinasa activada por mitógenos (MAPK), la proteína quinasa C (PKC). , proteína quinasa A (PKA) y Src. Esta cascada de eventos aumentará la excitabilidad de la neurona de salida y facilitará la transmisión de mensajes de dolor al cerebro.
- Desinhibición.En circunstancias normales, las interneuronas inhibidoras (azul) liberan continuamente GABA y / o glicina (Gly) para disminuir la excitabilidad de las neuronas de salida de la lámina I y modular la transmisión del dolor (tono inhibidor). Sin embargo, en el contexto de una lesión, esta inhibición se puede perder, dando lugar a hiperalgesia. Además, la desinhibición puede permitir A? Mielinizados no nociceptivos? aferentes primarios para activar los circuitos de transmisión del dolor de modo que los estímulos normalmente inocuos ahora se perciban como dolorosos. Esto ocurre, en parte, a través de la desinhibición de la PKC excitadora. expresando interneuronas en la lámina interna II.
- Activación microglial.La lesión del nervio periférico promueve la liberación de ATP y la quimiocina fractalcina que estimulará las células microgliales. En particular, la activación de los receptores purinérgicos, CX3CR1 y tipo Toll en la microglía (púrpura) da como resultado la liberación del factor neurotrófico derivado del cerebro (BDNF), que a través de la activación de los receptores TrkB expresados por las neuronas de salida de la lámina I, promueve una mayor excitabilidad y aumento del dolor en respuesta a estimulación tanto nociva como inocua (es decir, hiperalgesia y alodinia). La microglía activada también libera una gran cantidad de citocinas, como el factor de necrosis tumoral. (¿TNF?), ¿Interleucina-1? y 6 (IL-1 ?, IL-6), y otros factores que contribuyen a la sensibilización central.
El medio químico de la inflamación
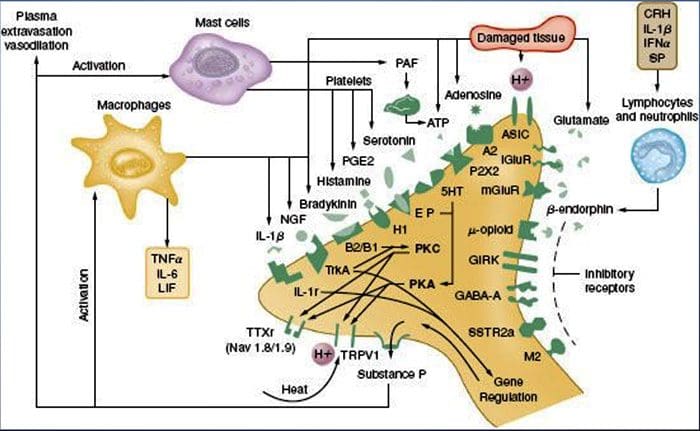
La sensibilización periférica resulta más comúnmente de cambios asociados con la inflamación en el entorno químico de la fibra nerviosa (McMahon et al., 2008). Por lo tanto, el daño tisular a menudo se acompaña de la acumulación de factores endógenos liberados por nociceptores activados o células no neuronales que residen o se infiltran en el área lesionada (incluidos mastocitos, basófilos, plaquetas, macrófagos, neutrófilos, células endoteliales, queratinocitos y fibroblastos). Colectivamente. Estos factores, denominados `` sopa inflamatoria '', representan una amplia gama de moléculas de señalización, que incluyen neurotransmisores, péptidos (sustancia P, CGRP, bradicinina), eicosinoides y lípidos relacionados (prostaglandinas, tromboxanos, leucotrienos, endocannabinoides), neurotrofinas, citocinas. y quimiocinas, así como proteasas y protones extracelulares. Sorprendentemente, los nociceptores expresan uno o más receptores de la superficie celular capaces de reconocer y responder a cada uno de estos agentes proinflamatorios o proalgésicos (Figura 4). Tales interacciones mejoran la excitabilidad de la fibra nerviosa, aumentando así su sensibilidad a la temperatura o al tacto.
Sin duda, el enfoque más común para reducir el dolor inflamatorio implica inhibir la síntesis o la acumulación de componentes de la sopa inflamatoria. Esto se ejemplifica mejor con fármacos antiinflamatorios no esteroideos, como la aspirina o el ibuprofeno, que reducen el dolor inflamatorio y la hiperalgesia al inhibir las ciclooxigenasas (Cox-1 y Cox-2) implicadas en la síntesis de prostaglandinas. Un segundo enfoque es bloquear las acciones de los agentes inflamatorios en el nociceptor. Aquí, destacamos ejemplos que proporcionan una nueva visión de los mecanismos celulares de la sensibilización periférica, o que forman la base de nuevas estrategias terapéuticas para tratar el dolor inflamatorio.
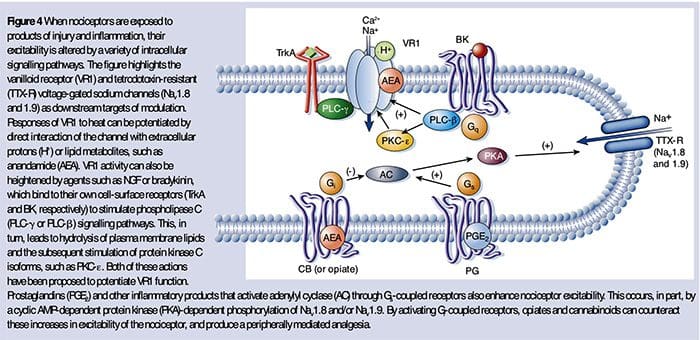
El NGF es quizás mejor conocido por su papel como factor neurotrófico requerido para la supervivencia y el desarrollo de las neuronas sensoriales durante la embriogénesis, pero en el adulto, el NGF también se produce en el contexto de la lesión tisular y constituye un componente importante de la sopa inflamatoria (Ritner et al. al., 2009). Entre sus muchos objetivos celulares, NGF actúa directamente sobre los nociceptores de fibra C peptidergic, que expresan la tirosina quinasa receptora de NGF de alta afinidad, TrkA, así como el receptor de neurotrofina de baja afinidad, p75 (Chao, 2003, Snider y McMahon, 1998). El NGF produce una hipersensibilidad profunda al calor y a estímulos mecánicos a través de dos mecanismos temporalmente distintos. Al principio, una interacción NGF-TrkA activa las vías de señalización aguas abajo, incluida la fosfolipasa C (PLC), la proteína quinasa activada por mitógeno (MAPK) y la fosfoinosítida 3-quinasa (PI3K). Esto da como resultado la potenciación funcional de proteínas diana en el terminal nociceptor periférico, más notablemente TRPV1, que conduce a un cambio rápido en la sensibilidad al calor celular y conductual (Chuang et al., 2001).
Independientemente de sus mecanismos pronociceptivos, la interferencia con la señalización de neurotrofinas o citocinas se ha convertido en una estrategia importante para controlar la enfermedad inflamatoria o el dolor resultante. El enfoque principal consiste en bloquear NGF o TNF-? acción con un anticuerpo neutralizante. En el caso del TNF - \ alpha, éste ha sido notablemente eficaz en el tratamiento de numerosas enfermedades autoinmunes, incluida la artritis reumatoide, lo que conduce a una reducción drástica tanto de la destrucción de tejidos como de la hiperalgesia acompañante (Atzeni et al., 2005). Debido a que las principales acciones del NGF sobre el nociceptor adulto ocurren en el contexto de la inflamación, la ventaja de este enfoque es que la hiperalgesia disminuirá sin afectar percepción normal del dolor. De hecho, los anticuerpos anti-NGF están actualmente en ensayos clínicos para el tratamiento de síndromes de dolor inflamatorio (Hefti et al., 2006).
Glutamato / sensibilización mediada por el receptor de NMDA
El dolor agudo se manifiesta por la liberación de glutamato desde los terminales centrales de los nociceptores, generando corrientes postsinápticas excitadoras (EPSCs) en las neuronas de cuerno dorsal de segundo orden. Esto ocurre principalmente a través de la activación de AMPA postsináptico y subtipos de kainato de receptores de glutamato ionotrópicos. La suma de los EPSCs por debajo del umbral en la neurona postsináptica eventualmente dará como resultado la activación potencial y la transmisión del mensaje de dolor a las neuronas de orden superior.
Otros estudios indican que los cambios en la neurona de proyección, en sí mismo, contribuyen al proceso de inhibición. Por ejemplo, la lesión del nervio periférico regula negativamente profundamente el K-co-transportador de K + - Cl-, que es esencial para mantener los gradientes K + y Cl- normales a través de la membrana plasmática (Coull et al., 2). La regulación negativa de KCC2003, que se expresa en las neuronas de proyección de la lámina I, da como resultado un cambio en el gradiente C1, de modo que la activación de los receptores GABA-A se despolariza, en lugar de hiperpolarizar las neuronas de proyección de la lámina I. Esto, a su vez, mejoraría la excitabilidad y aumentaría la transmisión del dolor. De hecho, el bloqueo farmacológico o la regulación a la baja mediada por siRNA de KCC2 en la rata induce alodinia mecánica.
Fuentes:
¿Por qué me duele el hombro? Una revisión de la base neuroanatómica y bioquímica del dolor de hombro
Benjamin John Floyd Dean, Stephen Edward Gwilym, Andrew Jonathan Carr
Mecanismos celulares y moleculares del dolor
Allan I. Basbaum1, Diana M. Bautista2, Gre? Gory Scherrer1 y David Julius3
1Departamento de Anatomía, Universidad de California, San Francisco 94158
2Departamento de Biología Molecular y Celular, Universidad de California, Berkeley CA 94720 3Departamento de Fisiología, Universidad de California, San Francisco 94158
Mecanismos moleculares de nocicepción
David Julius * y Allan I. Basbaum
*Department of Cellular and Molecular Pharmacology, and �Departments of Anatomy and Physiology and WM Keck Foundation Center for Integrative Neuroscience, University of California San Francisco, San Francisco, California 94143, USA (correo electrónico: julius@socrates.ucsf.edu)
Alcance de la práctica profesional *
La información aquí contenida en "Bioquímica del dolor" no pretende reemplazar una relación personal con un profesional de la salud calificado o un médico con licencia y no es un consejo médico. Lo alentamos a que tome decisiones de atención médica basadas en su investigación y asociación con un profesional de la salud calificado.
Información del blog y debates sobre el alcance
Nuestro alcance informativo se limita a la quiropráctica, musculoesquelética, medicina física, bienestar, contribuyendo etiológico alteraciones viscerosomáticas dentro de las presentaciones clínicas, la dinámica clínica del reflejo somatovisceral asociado, los complejos de subluxación, los problemas de salud delicados y/o los artículos, temas y debates de medicina funcional.
Brindamos y presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista se rige por su ámbito de práctica profesional y su jurisdicción de licencia. Utilizamos protocolos funcionales de salud y bienestar para tratar y apoyar la atención de lesiones o trastornos del sistema musculoesquelético.
Nuestros videos, publicaciones, temas, asuntos e ideas cubren cuestiones clínicas, problemas y temas que se relacionan y respaldan directa o indirectamente nuestro ámbito de práctica clínica.*
Nuestra oficina ha intentado razonablemente proporcionar citas de apoyo y ha identificado el estudio o los estudios de investigación relevantes que respaldan nuestras publicaciones. Proporcionamos copias de los estudios de investigación de respaldo disponibles para las juntas reguladoras y el público a pedido.
Entendemos que cubrimos asuntos que requieren una explicación adicional de cómo puede ayudar en un plan de atención o protocolo de tratamiento en particular; por lo tanto, para discutir más a fondo el tema anterior, no dude en preguntar Dr. Alex Jiménez, DC, o póngase en contacto con nosotros en 915-850-0900.
Estamos aquí para ayudarlo a usted y a su familia.
Bendiciones
El Dr. Alex Jimenez corriente continua MSACP, enfermero*, CCCT, IFMCP*, CIFM*, ATN*
email: coach@elpasomedicinafuncional.com
Licenciado como Doctor en Quiropráctica (DC) en Texas & New Mexico*
Número de licencia de Texas DC TX5807, Nuevo México DC Número de licencia NM-DC2182
Licenciada como enfermera registrada (RN*) in Florida
Licencia de Florida Licencia de RN # RN9617241 (Control No. 3558029)
Estado compacto: Licencia multiestatal: Autorizado para ejercer en 40 Estados*
Dr. Alex Jiménez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mi tarjeta de presentación digital







