Sulforafano es un fitoquímico, una sustancia dentro del grupo isotiocianato de compuestos organosulfurados, que se encuentra en los vegetales crucíferos, como el brócoli, la col, la coliflor y las coles de Bruselas. También se puede encontrar en bok choy, col rizada, coles, hojas de mostaza y berros. Los estudios de investigación han demostrado que el sulforafano puede ayudar a prevenir varios tipos de cáncer Activando la producción de Nrf2., o factor relacionado con el factor eritroide 2 nuclear, un factor de transcripción que regula los mecanismos antioxidantes protectores que controlan la respuesta de la célula a los oxidantes. El propósito del siguiente artículo es describir la función del sulforafano.
Contenido
Resumen
El sistema antioxidante KEAP1-Nrf2-ARE es un medio principal por el cual las células responden al estrés oxidativo y xenobiótico. El sulforafano (SFN), un isotiocianato electrofílico derivado de vegetales crucíferos, activa la vía KEAP1-Nrf2-ARE y se ha convertido en una molécula de interés en el tratamiento de enfermedades en las que el estrés oxidativo crónico desempeña un papel etiológico importante. Aquí demostramos que las mitocondrias de las células epiteliales pigmentadas de la retina humana (RPE-1) tratadas con SFN se someten a una hiperfusión que es independiente tanto de Nrf2 como de su inhibidor citoplasmático KEAP1. Se ha informado que la fusión mitocondrial es citoprotectora al inhibir la formación de poros en las mitocondrias durante la apoptosis, y de manera consistente, mostramos la citoprotección independiente de Nrf2 de células tratadas con SFN expuestas al inductor de apoptosis, estaurosporina. Mecánicamente, el SFN mitiga el reclutamiento y / o la retención del factor de fisión soluble Drp1 en las mitocondrias y en los peroxisomas, pero no afecta la abundancia general de Drp1. Estos datos demuestran que las propiedades beneficiosas de SFN se extienden más allá de la activación del sistema KEAP1-Nrf2-ARE y requieren una mayor interrogación dado el uso actual de este agente en múltiples ensayos clínicos.
Palabras clave: Sulforafano, Nrf2, Drp1, Mitocondrias, Fisión, Fusión, Apoptosis
Introducción
Sulforaphane es un inhibidor independiente de Nrf2 de la fisión mitocondrial
El sulforafano (SFN) es un compuesto de isotiocianato derivado de la dieta más comúnmente de los vegetales crucíferos [56]. Se genera en las plantas como una respuesta xenobiótica a la depredación a través de la liberación vesicular de la enzima hidrolítica miosinasa de las células dañadas; esta enzima convierte los glucosinolatos en isotiocyantes [42]. Durante las últimas dos décadas, el SFN se ha caracterizado ampliamente por sus propiedades anticancerígenas, antioxidantes y antimicrobianas [57]. Gran parte de esta eficacia se ha atribuido a la capacidad de SFN para modular la vía de señalización del elemento de respuesta antioxidante (ARE) KEAP1-Nrf2, aunque se han identificado actividades adicionales del compuesto, incluida la inhibición de la actividad de la histona desacetilasa y la progresión del ciclo celular [ 29]. Nrf2 es el principal factor de transcripción antioxidante y, en condiciones de homeostasis, su estabilidad se suprime a través de la acción del complejo citoplasmático de la ligasa Cullin3KEAP1 [20]. Específicamente, Nrf2 se recluta a la ligasa Cullin3KEAP1 mediante la unión al adaptador de sustrato dimérico KEAP1 y posteriormente se modifica con cadenas poliUb que apuntan al factor de transcripción para la degradación mediada por proteasoma. Esta rotación constitutiva limita la vida media de Nrf2 en celdas sin estrés a ~ 15 min [30], [33], [46], [55]. En respuesta a numerosos tipos de estrés, principalmente el estrés oxidativo, KEAP1, una proteína rica en cisteína, actúa como un sensor redox, y la modificación oxidativa de cisteínas críticas, particularmente C151, de KEAP1NUMX disocia Nrf2-KEAP1 de CUL3XXXXXXXXXXXXXNXX-KEAP2® 8], [20], [55]. En particular, SFN, y posiblemente otros activadores Nrf2, imitan el estrés oxidativo modificando C151 de KEAP1, por ejemplo, [21]. La estabilización de Nrf2 permite su translocación al núcleo donde induce la expresión de una batería de genes de desintoxicación y antioxidantes de fase II. Nrf2 se une a los elementos promotores de la respuesta antioxidante (ARE) de sus genes diana relacionados mediante la heterodimerización con pequeñas proteínas Maf [19]. Este sistema presenta una respuesta dinámica y sensible a los antioxidantes indirectos como SFN, los radicales libres generados por las mitocondrias [16] u otras fuentes fisiológicas de estrés oxidativo [41].
Las mitocondrias son orgánulos subcelulares dinámicos que regulan una gran cantidad de funciones celulares que van desde la producción de ATP y el amortiguamiento de calcio intracelular hasta la regulación redox y la apoptosis [13], [49]. Las mitocondrias también representan la principal fuente de especies reactivas de oxígeno (ROS) dentro de la célula. Por lo tanto, es necesaria una regulación adecuada de la función mitocondrial para optimizar la producción de ATP para satisfacer las necesidades celulares al tiempo que minimiza los efectos potencialmente dañinos de la producción excesiva de radicales libres. Un requisito crítico para la modulación fina de la función mitocondrial es la capacidad de las mitocondrias para funcionar de manera independiente como máquinas bioquímicas y como parte de una red amplia y receptiva.
La morfología y la función de la red mitocondrial están determinadas por un equilibrio regulado entre la fisión y la fusión. La fisión mitocondrial es necesaria para la herencia de las mitocondrias de células hijas durante la división celular [28], así como para la degradación autofágica y selectiva de las mitocondrias despolarizadas o dañadas, denominada mitofagia [1]. A la inversa, se requiere la fusión para complementar los genomas mitocondriales y compartir componentes de la cadena de transporte de electrones entre las mitocondrias vecinas [54]. A nivel molecular, la fisión mitocondrial y la fusión están reguladas por grandes GTPasas similares a dinaminas. Tres enzimas regulan principalmente la fusión: las mitofusinas 1 y 2 (Mfn1 / 2) son proteínas de membrana externa de dos pases que median la fusión de la membrana externa mediante interacciones heterotípicas entre mitocondrias adyacentes [15], [25], [37], mientras que OPA1 es un interior Proteína de membrana que asegura simultáneamente la conectividad de la matriz regulando la fusión de las membranas internas [5]. La actividad GTPasa de las tres proteínas se requiere para una fusión robusta [5], [18], y OPA1 está más regulada por la proteólisis compleja dentro de la membrana interna mitocondrial por las proteasas OMA1 [14], PARL [6], y YME1L [45] ]. Es importante destacar que se requiere un potencial de membrana mitocondrial intacto para una fusión eficiente con el fin de suprimir la integración de las mitocondrias dañadas y sanas [26].
La fisión mitocondrial es principalmente catalizada por una proteína citosólica llamada proteína relacionada con Dynamin 1 (Drp1 / DNM1L). Drp1 se contrata desde el citosol hasta sitios prospectivos de fisión en la membrana externa mitocondrial [43]. Los principales receptores para Drp1 en la membrana externa son el factor de fisión mitocondrial (Mff) [32] y, en menor medida, la Fisión 1 (Fis1) [51]. Además, se descubrió un receptor señuelo, MIEF1 / MiD51, que actúa para limitar aún más la actividad de la proteína Drp1 en los posibles sitios de fisión [58]. Una vez acoplado a la membrana externa mitocondrial, Drp1 se oligomeriza en estructuras en forma de espiral alrededor del cuerpo de la mitocondria y luego utiliza la energía derivada de la hidrólisis de GTP para mediar la escisión física de las membranas internas y externas mitocondriales [17]. Los túbulos derivados del retículo endoplásmico actúan como un constrictor inicial de las mitocondrias antes de la oligomerización Drp1, lo que subraya la revelación de que las mitocondrias no constrictas son más anchas que la circunferencia permisiva de una espiral Drp1 completa [12]. La dinámica de la actina también es importante para las interacciones ER-mitocondrias que preceden a la fisión mitocondrial [24]. Además de su papel en la fisión mitocondrial, Drp1 cataliza la fisión de los peroxisomas [40].
Drp1 es muy similar a la proteína dinamina bien caracterizada porque ambas proteínas contienen un dominio GTPasa N-terminal, un dominio Medio que es crítico para la autooligomerización, y un dominio efector de GTPasa C-terminal [31]. Drp1 logra una selectividad para las membranas mitocondriales a través de una combinación de interacciones con sus proteínas receptoras Mff y Fis1 y también a través de su afinidad por la cardiolipina fosfolípida específica de mitocondrias a través del dominio único de inserción B de Drp1 [2]. Drp1 generalmente existe como un homotetramer en el citoplasma, y el ensamblaje de orden superior en los sitios de fisión mitocondrial está mediado por el dominio Medio de Drp1 [3].
Dado el vínculo implícito entre la función mitocondrial y la ruta KEAP1-Nrf2-ARE, investigamos los efectos de la activación de Nrf2 en la estructura y función mitocondrial. Aquí demostramos que SFN induce hiperfusión mitocondrial que, inesperadamente, es independiente tanto de Nrf2 como de KEAP1. Este efecto de SFN es a través de una inhibición de la función Drp1. También demostramos que SFN confiere resistencia a la apoptosis que es independiente de Nrf2 e imita a la observada en células agotadas de Drp1. Estos datos indican colectivamente que, además de estabilizar y activar Nrf2, SFN modula la dinámica mitocondrial y preserva la capacidad y la supervivencia celular.
Resultados
El sulforafano induce hiperfusión de mitocondrias independiente de Nrf2 / KEAP1
En el curso del estudio de los efectos de la activación de Nrf2 en la dinámica de la red mitocondrial, descubrimos que el tratamiento de células epiteliales pigmentarias retinianas humanas (RPE-1) inmortalizadas con sulforafano (SFN), un potente activador de la señalización de Nrf2, inducía una fusión robusta de la red mitocondrial en comparación con las células de control tratadas con vehículo (Fig. 1A y B). La morfología de las mitocondrias en estas células se parecía mucho a la de las mitocondrias en células empobrecidas por ARNip de Drp1 endógeno, el principal factor de fisión mitocondrial (Fig. 1A). Este resultado planteó la intrigante idea de que el estado de fusión y fisión mitocondrial responde directamente a los niveles de Nrf2 en la célula. Sin embargo, la estimulación de las células con otros estabilizadores y activadores de Nrf2 como el inhibidor de proteasoma MG132, el prooxidante tBHQ o la desactivación del inhibidor de Nrf2 KEAP1 no indujeron la fusión mitocondrial (Fig. 1A y B). La estabilización de Nrf2 mediante estas manipulaciones se confirmó mediante transferencia Western para Nrf2 endógena (Fig. 1C). Además, la expresión de Nrf2 era prescindible para la fusión mitocondrial inducida por SFN, ya que la eliminación de Nrf2 endógena con ARNip no logró contrarrestar este fenotipo (Fig. 1D F). Debido a que SFN estimula la vía KEAP1-Nrf2-ARE modificando covalentemente residuos de cisteína de KEAP1 [21], derribamos KEAP1 para abordar si la hiperfusión mitocondrial inducida por SFN se estimula a través de una vía dependiente de KEAP1, pero independiente de Nrf2. Sin embargo, el agotamiento de KEAP1 tampoco logró derogar la fusión mitocondrial inducida por SFN (Fig. 1G I). De hecho, SFN revirtió la morfología de la profisión inducida por el agotamiento de KEAP1 (Fig. 1G, panel b versus panel d). Estos resultados indican que el tratamiento con SFN causa fusión mitocondrial independiente de la vía canónica KEAP1-Nrf2-ARE y nos llevó a cuestionar si SFN afecta directamente a componentes de la fisión mitocondrial o maquinaria de fusión.
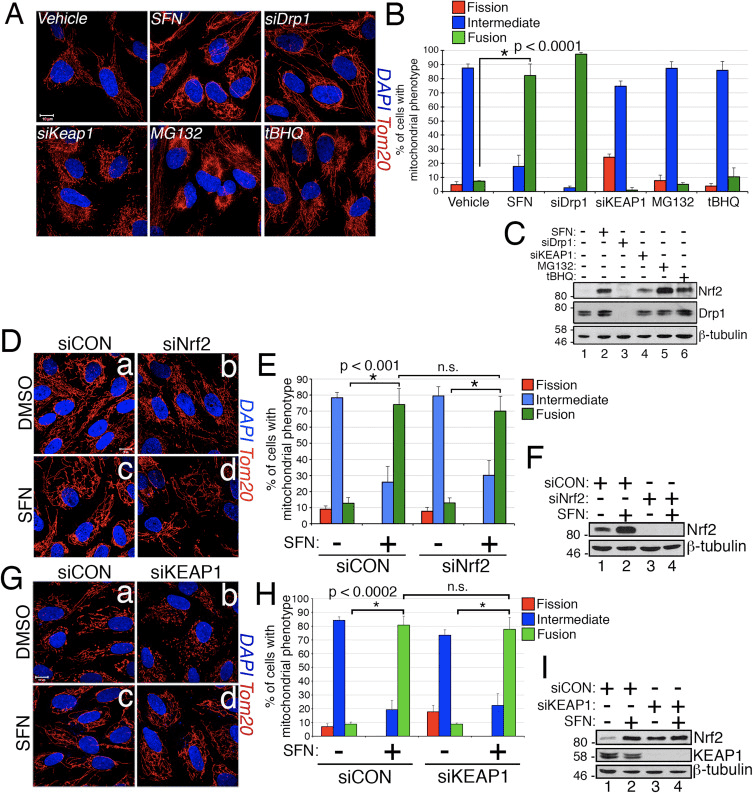
Sulforaphane daña la asociación mitocondrial de Drp1
En base al hallazgo de que el tratamiento con SFN induce hiperfusión mitocondrial, razonamos que este fenotipo era una consecuencia de una actividad de fusión excesiva o una inhibición de la actividad de fisión. Para discriminar entre estas dos posibilidades, comparamos la morfología de los peroxisomas en presencia y ausencia de SFN. Los peroxisomas son similares a las mitocondrias, ya que son orgánulos dinámicos cuya forma y longitud están constantemente en flujo [44]. Los peroxisomas contienen tanto Fis1 como Mff en su membrana externa y, como consecuencia, son objetivos para la fisión mediada por Drp1 [22], [23]. Sin embargo, los peroxisomas no utilizan la maquinaria de fusión de la red mitocondrial y, en consecuencia, no se someten a fusión [39]. Más bien, la fisión peroxisomal se opone al alargamiento de los peroxisomas existentes mediante la adición de novo de membranas y proteínas [44]. Debido a que los peroxisomas carecen de Mfn1 / 2 y OPA1, razonamos que si SFN activa la maquinaria de fusión en lugar de inhibir la maquinaria de fisión, la longitud del peroxisoma no se vería afectada. En las células tratadas con vehículo, los peroxisomas se mantienen como orgánulos puntiformes cortos y redondos (Fig. 2, paneles byd). Sin embargo, el tratamiento con SFN aumentó la longitud del peroxisoma en ~ 2-fold en comparación con las células de control (Fig. 2, paneles f y h). Además, muchos de los peroxisomas se pellizcaron cerca del centro, lo que indica un posible defecto de escisión (Fig. 2, panel h, puntas de flecha). Del mismo modo, los peroxisomas en las células transfectadas con Drp1 siRNA fueron anormalmente largos (Fig. 2, paneles j y l), lo que confirma que Drp1 es necesario para la fisión peroxisomal y sugiere que el tratamiento con SFN causa fenotipos mitocondriales y peroxisómicos al interrumpir la maquinaria de la fisión.
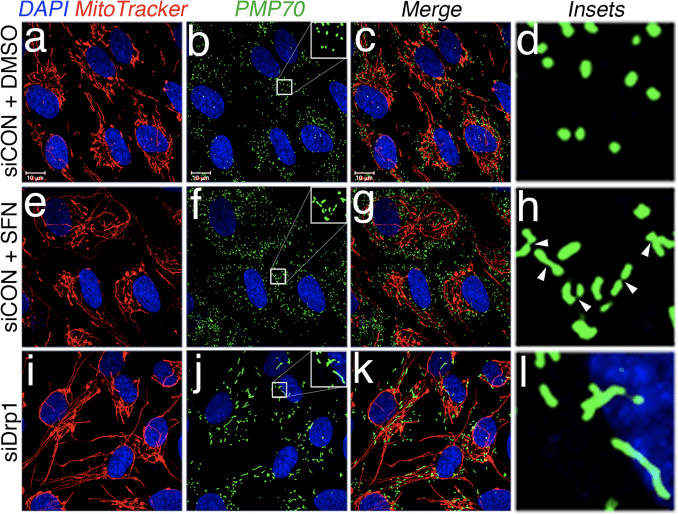
A continuación, determinamos cómo SFN restringe la función Drp1. Las posibilidades incluían reducciones en los niveles de expresión, reclutamiento / retención en las mitocondrias, oligomerización o actividad enzimática de la GTPasa. Un déficit en cualquiera de estos daría como resultado una reducción de la fisión e hiperfusión mitocondrial. No detectamos cambios reproducibles en los niveles de proteína Drp1 después del tratamiento con SFN (Figs. 1C y 3A) y, por lo tanto, concluimos que SFN no altera la estabilidad o expresión de Drp1, lo que es consistente con Drp1 que tiene una vida media de> 10 h [50] y nuestros tratamientos SFN son de menor duración. A continuación, investigamos si SFN afectaba el reclutamiento o la retención de Drp1 en las mitocondrias. Los estudios de fraccionamiento mostraron que SFN indujo una pérdida de Drp1 de la fracción mitocondrial (Fig. 3A, carriles 7-8 y Fig. 3B). Como se informó anteriormente [43], sólo una pequeña fracción de Drp1 (~ 3%) se asocia con la red mitocondrial en un momento dado durante condiciones de estado estacionario con la mayor parte de la enzima residiendo en el citoplasma (Fig. 3A, carriles 5-8 ). Estos datos de fraccionamiento se confirmaron utilizando un análisis de colocalización que mostró una reducción de ~ 40% en los focos Drp1 punteados localizados en las mitocondrias después del tratamiento con SFN (Fig. 3C y D). Juntos, estos datos indican que la fusión mitocondrial inducida por SFN se debe, al menos parcialmente, a la asociación atenuada de Drp1 con las mitocondrias. Nuestros datos no distinguen entre si SFN interfiere con el reclutamiento mitocondrial versus la retención mitocondrial de Drp1, o ambos, ya que el análisis de Drp1 endógeno no fue susceptible de visualizar la GTPasa por microscopía de células vivas.
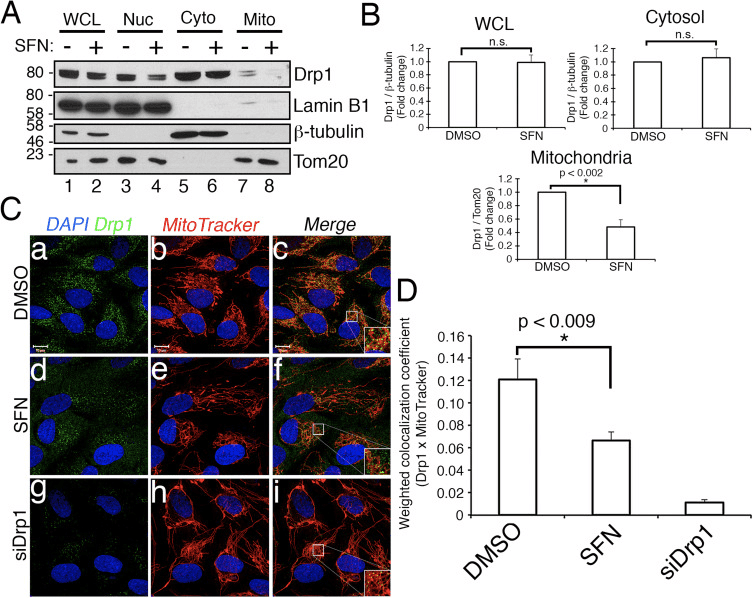
Sulforaphane confiere protección contra la apoptosis inducida por estaurosportina independiente de Nrf2
Trabajos anteriores han demostrado que la fisión mitocondrial es permisiva en la formación de poros en la membrana mitocondrial externa generada por Bax / Bak durante la apoptosis [11]. Se ha demostrado que Drp1 se recluta selectivamente en las mitocondrias durante la apoptosis [11] y, de acuerdo con esto, se han observado mitocondrias fragmentadas al principio del proceso [27]. Por el contrario, se cree que la inhibición de la fisión mitocondrial inhibe la apoptosis al bloquear la formación de los poros de la membrana externa que permiten la liberación del citocromo c [53]. En consecuencia, estimular la fusión mitocondrial retrasa la progresión de la apoptosis inducida por compuestos como la estaurosporina (STS) [14]. Para determinar si SFN protege las células RPE-1 de la apoptosis mediada por STS y, de ser así, si esto requiere Nrf2, establecimos un ensayo para inducir fácilmente la escisión de poli ADP ribosa polimerasa (PARP), un sustrato de la caspasa-3 activada y marcador definitivo de apoptosis. El tratamiento de las células RPE-1 con STS 1 µM durante 6 h solo provocó una escisión muy modesta de PARP, pero esto se evitó mediante el co-tratamiento con SFN (p. Ej., Fig. 4A, carril 3 frente a 4). Para aumentar la solidez de este ensayo, sensibilizamos aún más las células a la apoptosis inducida por STS tratándolas previamente con ARNip dirigido al factor antiapoptótico, Bcl-XL. Este pretratamiento redujo la expresión de Bcl-XL y promovió notablemente la escisión de PARP en función del tiempo de exposición a STS (Fig. 4B, compare el carril 2 con los carriles 4-10). Es importante destacar que 2 h de pretratamiento con SFN mitigó la escisión de PARP en células expuestas a STS (Fig. 4C, carril 3 frente a 4 y carril 5 frente a 6). Asimismo, las células empobrecidas de manera estable de Nrf2 por CRISPR / Cas9 se protegieron de manera comparable de la toxicidad de STS mediante el pretratamiento con SFN (Fig. 4C, carril 11 frente a 12 y carril 13 frente a 14 y figura 4D). Esta protección se observó usando tanto la escisión de PARP (Fig. 4C y D) como la morfología celular (Fig. 4E) como lecturas. La eficacia del agotamiento de Nrf2 por CRISPR / Cas9 se confirmó mediante transferencia de Western (Fig. 4C, transferencia de Nrf2). Como se predijo, las células agotadoras de Drp1, que también producen un fenotipo de hiperfusión (Fig. 1A), también bloquearon la escisión de PARP en respuesta a STS en comparación con las células de control incubadas con SFN (Fig. 4F y G). Juntos, estos hallazgos son consistentes con SFN que confiere protección contra la apoptosis a través de su capacidad para restringir la función de Drp1, independientemente de la estabilización y activación de Nrf2.
Discusión
Hemos descubierto que SFN modula la dinámica de fusión / fisión mitocondrial independientemente de sus efectos en la ruta KEAP1-Nrf2-ARE. Esto es intrigante debido a un vínculo asumido entre la disfunción mitocondrial y la producción de ROS y la necesidad de sofocar los radicales libres derivados de la mitocondria a través de la activación de Nrf2. Este impacto funcional adicional de SFN es de importancia potencial dado que hay más de 30 ensayos clínicos actualmente en curso que prueban SFN para el tratamiento de una variedad de enfermedades que incluyen cáncer de próstata, enfermedad pulmonar obstructiva y enfermedad de células falciformes [7], [10], [ 47].
Debido a que SFN es un isotiocianato [56] y activa la señalización de Nrf2 al acilar directamente las cisteínas críticas de KEAP1 para suprimir la degradación de Nrf2 [21], se deduce que SFN ejerce sus efectos pro-fusión modulando la actividad de una fisión o un factor de fusión a través de una modificación de cisteína. . Nuestros datos respaldan firmemente que Drp1 sea regulado negativamente por SFN, aunque aún no se ha determinado si la GTPasa es un objetivo directo de la acilación. A pesar de esta brecha de conocimiento, la función de Drp1 está claramente comprometida por SFN, ya que tanto las mitocondrias como los peroxisomas se hiperfunden en respuesta al tratamiento con SFN y estas orgánulas comparten Drp1 por sus respectivos eventos de escisión [38]. Además, SFN disminuye la cantidad de Drp1 que se localiza y acumula en las mitocondrias (Fig. 3). Debido a que nuestros experimentos se realizaron con todas las proteínas endógenas, nuestra detección de Drp1 en los sitios de fisión mitocondrial se encuentra en condiciones de estado estacionario y, por lo tanto, no podemos distinguir entre un reclutamiento y un defecto de retención de la enzima causada por el SFN. Además, no podemos eliminar la posibilidad de que SFN acila un receptor en las mitocondrias (Fis1 o Mff) para bloquear el reclutamiento de Drp1. Sin embargo, sospechamos que Drp1 está directamente modificado. Drp1 tiene nueve cisteínas, ocho de las cuales residen en el dominio medio que se requieren para la oligomerización [3], y una de ellas reside en el dominio de efector de GTPasa (GED) en el extremo C de Drp1. La acilación directa de cualquiera de estas cisteínas podría causar un defecto de actividad en Drp1 y, por lo tanto, subyace al efecto de SFN en la dinámica mitocondrial. En particular, trabajos anteriores sugieren que los defectos en la oligomerización y la actividad catalítica pueden abrogar la retención de Drp1 en las mitocondrias [52]. Cys644 en el dominio GED es un objetivo particularmente atractivo basado en un trabajo previo que muestra la mutación de esta fenocopia de cisteína mutaciones que afectan la actividad de la GTPasa de Drp1 [4] y que esta cisteína en particular está modificada por electrofilos reactivos al tiol [9]. La resolución de esta pregunta pendiente requerirá una validación espectrométrica de masas. En resumen, hemos identificado una nueva función citoprotectora para el SFN compuesto clínicamente relevante. Además de activar el factor de transcripción antioxidante maestro Nrf2, SFN promueve la fusión mitocondrial y peroxisomal, y este efecto es independiente de Nrf2. El mecanismo subyacente a este fenómeno implica una reducción en la función de la GTPasa Drp1, el mediador primario de la fisión mitocondrial y peroxisomal. Una de las principales consecuencias de la fusión mitocondrial mediada por SFN es que las células se vuelven resistentes a los efectos tóxicos de la apurosis inductor de la apuroosis. Esta acción citoprotectora adicional de SFN podría ser de particular utilidad clínica en las numerosas enfermedades neurodegenerativas para las cuales la edad es el principal factor de riesgo (p. Ej., Enfermedad de Parkinson, enfermedad de Alzheimer, degeneración macular relacionada con la edad) ya que estas enfermedades se han asociado con apoptosis y se han reducido. niveles y / o desregulación de Nrf2 [35], [36], [48].
Materiales y Métodos
Ensayos de apoptosis
Las células se sembraron y transfectaron con ARNip como se indica a continuación. Las células se pretrataron con sulforafano 50 \ mu M durante 2 h para inducir la fusión mitocondrial y luego se trataron con estaurosporina 1 \ mu M para inducir la apoptosis. En el momento de la recolección, el medio se recogió en tubos individuales y se sometió a centrifugación a alta velocidad para sedimentar las células apoptóticas. Este sedimento celular se combinó con células adherentes y se solubilizó en tampón Laemmli concentrado 2 veces. Las muestras se sometieron a inmunotransferencia de tipo anti-PARP.
Generación de construcciones CRISPR / Cas9
Para crear LentiCRISPR / eCas9 1.1, LentiCRISPR v2 (addgene #52961) primero se cortó con Age1 y BamH1. A continuación, se amplificó la PCR con los voladizos de la fuente de luz de la mano de la máquina de la mano y de la mano de la mano de la máquina de la mano, y también de la mano de la mano. Las secuencias de sgRNA se determinaron utilizando Benchling.com. Los parámetros se establecieron para apuntar a la secuencia de codificación con las puntuaciones más altas dentro del objetivo y más bajas fuera del objetivo. Las siguientes secuencias (secuencia de dirección subrayado, HS sgNFE9L9 # 1.1 sentido CACCGCGACGGAAAGAGTATGAGC, antisentido AAACGCTCATACTCTTTCCGTCGC; hs sgNFE71814L1 # 1 CACCGGTTTCTGACTGGATGTGCT sentido, AAACAGCACATCCAGTCAGAAACC antisentido; hs sgNFE2L2 # 1 sentido CACCGGAGTAGTTGGCAGATCCAC, antisentido AAACGTGGATCTGCCAACTACTCC) se reasociaron y se ligaron en BsmB2 cortó LentiCRISPR / eCas2 2. Se seleccionaron células RPE-2 infectadas con lentitis con puromicina y se mantuvieron como una población agrupada. El golpe de gracia se confirmó mediante inmunofluorescencia y transferencia de Western.
Cultivo Celular y Transfecciones
Se cultivaron células epiteliales pigmentadas de la retina humana transformadas con telomerasa (RPE-1) (ATCC) en medio Eagle modificado de Dulbecco (DMEM) que contenía 1 g / L de glucosa suplementado con penicilina, estreptomicina, cóctel de aminoácidos no esenciales 1X (Life Technologies), y suero bovino fetal al 10% (Life Technologies). Para las transfecciones de ARNip, se sembraron 30,000 a 35,000 células / ml durante la noche. Las células recibieron ARNip 10 nM diluido en DMEM sin suero y combinado con reactivo de transfección de interferina al 0.3% (PolyPlus). Para la sensibilización a la apoptosis, las células recibieron ARNip de Bcl-XL 1 nM. Las células se recolectaron 2-3 días después de la transfección.
Productos químicos, anticuerpos y oligos siRNA
Anticuerpos contra? -Tubulina (señalización celular),? -Tubulina (Sigma), Drp1 (BD Biosciences), KEAP1 (Proteintech), Lamin B1 (Abcam), PARP (señalización celular), PMP70 (Abcam) y Tom20 (BD Biosciences) ) se utilizaron en diluciones 1: 1000 para transferencia Western y para inmunofluorescencia. En casa, se utilizó anticuerpo de conejo anti-Nrf2 a 1: 2000 para la transferencia de Western [34], [59]. Se utilizaron sulforafano (Sigma) y estaurosporina (Tocris) a 50 \ mu M y 1 \ mu M respectivamente. Se usaron ARNip contra Drp1 (Dharmacon), Nrf2 (Dharmacon), KEAP1 (Señalización celular) y Bcl-XL (Señalización celular) a 10 nM a menos que se indique lo contrario.
Inmunofluorescencia y etiquetado in vivo.
Las células sembradas en cubreobjetos de vidrio de 18 mm se trataron con vehículo o fármaco, se fijaron en formaldehído al 3.7% y luego se permeabilizaron en Triton X-0.2 / PBS al 100% en hielo durante 10 min. Los anticuerpos primarios se incubaron en albúmina de suero bovino (BSA) al 3% en PBS durante la noche a 4 ° C. Después de los lavados con PBS, las células se incubaron durante 1 h en anticuerpos secundarios conjugados, Alexa488 o Alexa546, apropiados para la especie (diluidos 1: 1000) y DAPI (Sigma) 0.1 μg / ml en BSA / PBS al 3%. Las mitocondrias se visualizaron mediante inmunofluorescencia anti-Tom20 o incubando células en 200 nM MitoTracker Red CMXRos (Molecular Probes, Inc.) en DMEM sin suero durante 30 min a 37 ° C antes de la fijación.
Microscopía y Análisis de Imagen.
Las muestras de inmunofluorescencia se observaron en un microscopio confocal LSM710 (Carl Zeiss). Las micrografías se capturaron utilizando objetivos de inmersión en aceite 63X o 100X y las imágenes se ajustaron y mejoraron utilizando Adobe Photoshop CS6. El análisis de co-localización se realizó utilizando la función de co-localización Carl Zeiss LSM710 con umbrales establecidos manualmente mientras se desconocía la identidad de las muestras. Las barras de escala a lo largo, a menos que se indique lo contrario, son de 10 m. La morfología mitocondrial se evaluó mediante puntuación ciega. Si las mitocondrias de una célula se mantuvieron como puntos múltiples, redondos y discriminados, la célula se puntuó como `` fisión ''. Si las mitocondrias individuales eran indistinguibles y toda la red mitocondrial parecía continua, la célula se calificaba como `` fusión ''. Todas las demás células, incluidas aquellas con mitocondrias agrupadas, se calificaron como `` intermedias ''.
Fraccionamientos subcelulares
Las células RPE-1 se cultivaron hasta la confluencia. Después de un lavado con PBS, las células se sometieron a centrifugación a 600 μg durante 10 min y se resuspendieron en 600 μl de tampón de aislamiento (manitol 210 mM, sacarosa 70 mM, MOPS 5 mM, EDTA 1 mM pH 7.4 + PMSF 1 mM). La suspensión se lisó 30 veces en un homogeneizador Dounce. Una fracción del homogeneizado se conservó como un `` lisado celular completo ''. El resto se sometió a centrifugación a 800 g durante 10 min para sedimentar los núcleos. Los sobrenadantes se sometieron a centrifugación a 1500 g durante 10 minutos para limpiar los núcleos restantes y las células no lisadas. Este sobrenadante se sometió a centrifugación a 15,000 g durante 15 min para sedimentar las mitocondrias. El sobrenadante se conservó como la `` fracción citosólica ''. El sedimento se lavó suavemente con PBS y se resuspendió en tampón de aislamiento. La concentración de proteína de cada fracción se midió mediante un ensayo de ácido bicinconínico (BCA) y las cantidades equivalentes de proteína se resolvieron mediante SDS-PAGE.
Western Blot
Las células se lavaron en PBS y se solubilizaron en tampón solubilizante de Laemmli concentrado 2 veces (Tris 100 mM [pH 6.8], SDS al 2%, azul de bromofenol al 0.008%, 2-mercaptoetanol al 2%, glicerol al 26.3% y pirinina Y al 0.001%). Los lisados se hirvieron durante 5 min antes de cargarlos en geles de poliacrilamida de dodecilsulfato de sodio (SDS). Las proteínas se transfirieron a membranas de nitrocelulosa y las membranas se bloquearon durante 1 h en Leche al 5% / TBST. Los anticuerpos primarios se diluyeron en leche al 5% / TBST y se incubaron con la mancha durante la noche a 4 ° C. Se diluyeron anticuerpos secundarios conjugados con peroxidasa de rábano picante (HRP) en leche al 5% / TBST. Las transferencias se procesaron con quimioluminiscencia mejorada y se realizaron cuantificaciones densitométricas utilizando el software ImageJ.

El sulforafano es un producto químico de la colección de isotiocianatos de sustancias organosulfuradas obtenidas de vegetales crucíferos, como el brócoli, el repollo, la coliflor, la col rizada y las coles, entre otros. El sulforafano se produce cuando la enzima mirosinasa transforma la glucorafanina, un glucosinolato, en sulforafano, también conocido como sulforafano-glucosinolato. Los brotes de brócoli y la coliflor tienen la mayor concentración de glucorafanina o el precursor de sulforafano. Los estudios de investigación han demostrado que el sulforafano mejora las capacidades antioxidantes del cuerpo humano para prevenir diversos problemas de salud. Dr. Alex Jimenez DC, CCST Insight
El sulforafano y sus efectos sobre el cáncer, la mortalidad, el envejecimiento, el cerebro y el comportamiento, las enfermedades cardíacas y más
Los isotiocianatos son algunos de los compuestos vegetales más importantes que puede obtener en su dieta. En este video hago el caso más completo para ellos que se haya hecho. ¿Periodo de atención corto? Salta a tu tema favorito haciendo clic en uno de los puntos de tiempo a continuación. Línea de tiempo completa a continuación.
Secciones clave:
- 00: 01: 14 - Cáncer y mortalidad
- 00: 19: 04 - Envejecimiento
- 00: 26: 30 - Cerebro y comportamiento
- 00: 38: 06 - Resumen final
- 00: 40: 27 - Dosis
Línea de tiempo completa:
- 00: 00: 34 - Introducción de sulforafano, un enfoque importante del video.
- 00: 01: 14 - Consumo de vegetales crucíferos y reducciones en la mortalidad por todas las causas.
- 00: 02: 12 - Riesgo de cáncer de próstata.
- 00: 02: 23 - Riesgo de cáncer de vejiga.
- 00: 02: 34 - El cáncer de pulmón en riesgo de los fumadores.
- 00: 02: 48 - Riesgo de cáncer de mama.
- 00: 03: 13 - Hipotético: ¿qué sucede si ya tiene cáncer? (intervencionista)
- 00: 03: 35: mecanismo plausible que impulsa los datos asociativos del cáncer y la mortalidad.
- 00: 04: 38 - Sulforafano y cáncer.
- 00: 05: 32 - Evidencia en animales que muestra un fuerte efecto del extracto de brócoli en el desarrollo de tumores de vejiga en ratas.
- 00: 06: 06 - Efecto de la suplementación directa de sulforafano en pacientes con cáncer de próstata.
- 00: 07: 09 - Bioacumulación de metabolitos de isotiocianato en el tejido mamario real.
- 00: 08: 32 - Inhibición de las células madre del cáncer de mama.
- 00: 08: 53 - Lección de historia: Brassicas se establecieron con propiedades de salud incluso en la antigua Roma.
- 00: 09: 16 - Capacidad de sulforafano para mejorar la excreción de carcinógenos (benceno, acroleína).
- 00: 09: 51 - NRF2 como un interruptor genético a través de elementos de respuesta antioxidante.
- 00: 10: 10: cómo la activación de NRF2 mejora la excreción de carcinógenos a través de los conjugados de glutatión-S.
- 00: 10: 34 - Las coles de Bruselas aumentan la glutatión-S-transferasa y reducen el daño al ADN.
- 00: 11: 20 - La bebida de brotes de brócoli aumenta la excreción de benceno en un 61%.
- 00: 13: 31 - El homogeneizado de brotes de brócoli aumenta las enzimas antioxidantes en las vías respiratorias superiores.
- 00: 15: 45 - Consumo de vegetales crucíferos y mortalidad por enfermedades del corazón.
- 00: 16: 55 - El brote en polvo de brócoli mejora los lípidos en la sangre y el riesgo general de enfermedad cardíaca en los diabéticos tipo 2.
- 00: 19: 04 - Inicio de la sección de envejecimiento.
- 00: 19: 21 - La dieta enriquecida con sulforafano aumenta la vida útil de los escarabajos de 15 a 30% (en ciertas condiciones).
- 00: 20: 34 - Importancia de la inflamación baja para la longevidad.
- 00: 22: 05 - Las verduras crucíferas y el brote de brócoli en polvo parecen reducir una amplia variedad de marcadores inflamatorios en los humanos.
- 00: 23: 40 - Resumen del medio video: cáncer, envejecimiento, secciones
- 00: 24: 14: los estudios con ratones sugieren que el sulforafano podría mejorar la función inmunológica adaptativa en la vejez.
- 00: 25: 18 - Sulforaphane mejoró el crecimiento del cabello en un modelo de ratón de calvicie. Imagen en 00: 26: 10.
- 00: 26: 30 - Inicio del cerebro y sección de comportamiento.
- 00: 27: 18 - Efecto del extracto de brotes de brócoli en el autismo.
- 00: 27: 48 - Efecto de la glucorafanina sobre la esquizofrenia.
- 00: 28: 17 - Inicio de la discusión sobre la depresión (mecanismo plausible y estudios).
- 00: 31: 21: el estudio con ratones que utiliza los diferentes modelos de depresión inducida por el estrés de 10 muestra que el sulforafano es igualmente eficaz que la fluoxetina (prozac).
- 00: 32: 00 - El estudio muestra que la ingesta directa de glucorafanina en ratones es igualmente efectiva para prevenir la depresión por el modelo de estrés por derrota social.
- 00: 33: 01 - Inicio de la sección de neurodegeneración.
- 00: 33: 30 - Sulforafano y enfermedad de Alzheimer.
- 00: 33: 44 - Sulforaphane y enfermedad de Parkinson.
- 00: 33: 51 - Sulforaphane y la enfermedad de Hungtington.
- 00: 34: 13 - Sulforaphane aumenta las proteínas de choque térmico.
- 00: 34: 43 - Inicio de la sección de lesión cerebral traumática.
- 00: 35: 01 - Sulforaphane inyectado inmediatamente después de un TBI mejora la memoria (estudio en ratones).
- 00: 35: 55 - Sulforafano y plasticidad neuronal.
- 00: 36: 32 - Sulforaphane mejora el aprendizaje en un modelo de diabetes tipo II en ratones.
- 00: 37: 19 - Distrofia muscular de sulforafano y duchenne.
- 00: 37: 44 - Inhibición de la miostatina en células satélite de músculo (in vitro).
- 00: 38: 06 - Resumen de video tardío: mortalidad y cáncer, daño en el ADN, estrés oxidativo e inflamación, excreción de benceno, enfermedad cardiovascular, diabetes tipo II, efectos en el cerebro (depresión, autismo, esquizofrenia, neurodegeneración), NRF2.
- 00: 40: 27 - Reflexiones sobre cómo calcular una dosis de brotes de brócoli o sulforafano.
- 00: 41: 01 - Anécdotas sobre la brotación en el hogar.
- 00: 43: 14 - En temperaturas de cocción y actividad de sulforafano.
- 00: 43: 45 - Conversión de las bacterias intestinales del sulforafano a partir de glucorafanina.
- 00: 44: 24 - Los suplementos funcionan mejor cuando se combinan con la mirosinasa activa de vegetales.
- 00: 44: 56 - Técnicas de cocción y verduras crucíferas.
- 00: 46: 06 - Isotiocianatos como goitrógenos.
Agradecimientos
Sciencedirect.com/science/article/pii/S2213231716302750
¿Cómo se produce el sulforafano?
El calentamiento disminuye la actividad de la proteína epitiospecificadora y aumenta la formación de sulforafano en el brócoli
Resumen
El sulforafano, un isotiocianato del brócoli, es uno de los anticancerígenos derivados de los alimentos más potentes. Este compuesto no está presente en la verdura intacta, sino que se forma a partir de su precursor glucosinolato, la glucorafanina, por la acción de la mirosinasa, una enzima tioglucosidasa, cuando se tritura o mastica el tejido del brócoli. Sin embargo, varios estudios han demostrado que el rendimiento de sulforafano de la glucorafanina es bajo y que un análogo de nitrilo no bioactivo, el nitrilo de sulforafano, es el principal producto de hidrólisis cuando el tejido vegetal se tritura a temperatura ambiente. La evidencia reciente sugiere que en Arabidopsis, la formación de nitrilo a partir de glucosinolatos está controlada por una proteína sensible al calor, la proteína epitioespecificadora (ESP), un cofactor no catalítico de mirosinasa. Nuestros objetivos eran examinar los efectos de calentar las flores y los brotes de brócoli sobre la formación de sulforafano y nitrilo de sulforafano, para determinar si el brócoli contiene actividad ESP, y luego correlacionar los cambios dependientes del calor en la actividad ESP, el contenido de sulforafano y la bioactividad, medida por inducción Enzima de desintoxicación de fase II quinona reductasa (QR) en cultivo celular. Calentar floretes de brócoli frescos o brotes de brócoli a 60 ° C antes de la homogeneización aumentó simultáneamente la formación de sulforafano y disminuyó la formación de nitrilo de sulforafano. Una pérdida significativa de actividad ESP fue paralela a la disminución en la formación de nitrilo sulforafano. Calentar a 70 ° C y más disminuyó la formación de ambos productos en las flores de brócoli, pero no en los brotes de brócoli. La inducción de QR en células cultivadas de hepatoma Hepa lclc7 de ratón fue paralela a aumentos en la formación de sulforafano.

El precalentamiento de los floretes y brotes de brócoli a 60 ° C aumentó significativamente la formación de sulforafano (SF) catalizada por mirosinasa en extractos de tejido vegetal después de la trituración. Esto se asoció con una disminución en la formación de nitrilo sulforafano (nitrilo SF) y la actividad de la proteína epitioespecificadora (ESP).
Palabras clave: Brócoli, Brassica oleracea, Crucíferas, Cáncer, Anticarcinógeno, Sulforafano, Nilforforano, Nitrilo, Proteína Epitioespecífica, Quinona Reductasa
En conclusión, el sulforafano es un fitoquímico que se encuentra en el brócoli y otras verduras crucíferas. Una cantidad incontrolada de oxidantes causada por factores internos y externos puede causar estrés oxidativo en el cuerpo humano, lo que en última instancia puede conducir a una variedad de problemas de salud. El sulforafano puede activar la producción de Nrf2, un factor de transcripción que ayuda a regular los mecanismos antioxidantes protectores que controlan la respuesta celular a los oxidantes. El alcance de nuestra información se limita a cuestiones quiroprácticas y de salud espinal. Para discutir el tema, no dude en preguntarle al Dr. Jiménez o contáctenos en 915-850-0900 .
Comisariada por el Dr. Alex Jiménez
Remitido desde: Sciencedirect.com

Tema adicional de discusión: Dolor de espalda agudo
El dolor de espaldaEs una de las causas más frecuentes de discapacidad y días perdidos en el trabajo en todo el mundo. El dolor de espalda se atribuye a la segunda razón más común de visitas al consultorio médico, superada solo por las infecciones de las vías respiratorias superiores. Aproximadamente el 80 por ciento de la población experimentará dolor de espalda al menos una vez a lo largo de su vida. La columna vertebral es una estructura compleja formada por huesos, articulaciones, ligamentos y músculos, entre otros tejidos blandos. Debido a esto, lesiones y / o condiciones agravadas, como hernias discales, eventualmente puede conducir a síntomas de dolor de espalda. Las lesiones deportivas o las lesiones por accidentes automovilísticos suelen ser la causa más frecuente de dolor de espalda; sin embargo, a veces los movimientos más simples pueden tener resultados dolorosos. Afortunadamente, las opciones de tratamiento alternativo, como la atención quiropráctica, pueden ayudar a aliviar el dolor de espalda mediante el uso de ajustes espinales y manipulaciones manuales, mejorando finalmente el alivio del dolor.

EXTRA EXTRA | TEMA IMPORTANTE: El Paso, TX Quiropráctico
***
Alcance de la práctica profesional *
La información aquí contenida en "¿Qué es el sulforafano?" no pretende reemplazar una relación personal con un profesional de la salud calificado o un médico con licencia y no es un consejo médico. Lo alentamos a que tome decisiones de atención médica basadas en su investigación y asociación con un profesional de la salud calificado.
Información del blog y debates sobre el alcance
Nuestro alcance informativo se limita a la quiropráctica, musculoesquelética, medicina física, bienestar, contribuyendo etiológico alteraciones viscerosomáticas dentro de las presentaciones clínicas, la dinámica clínica del reflejo somatovisceral asociado, los complejos de subluxación, los problemas de salud delicados y/o los artículos, temas y debates de medicina funcional.
Brindamos y presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista se rige por su ámbito de práctica profesional y su jurisdicción de licencia. Utilizamos protocolos funcionales de salud y bienestar para tratar y apoyar la atención de lesiones o trastornos del sistema musculoesquelético.
Nuestros videos, publicaciones, temas, asuntos e ideas cubren cuestiones clínicas, problemas y temas que se relacionan y respaldan directa o indirectamente nuestro ámbito de práctica clínica.*
Nuestra oficina ha intentado razonablemente proporcionar citas de apoyo y ha identificado el estudio o los estudios de investigación relevantes que respaldan nuestras publicaciones. Proporcionamos copias de los estudios de investigación de respaldo disponibles para las juntas reguladoras y el público a pedido.
Entendemos que cubrimos asuntos que requieren una explicación adicional de cómo puede ayudar en un plan de atención o protocolo de tratamiento en particular; por lo tanto, para discutir más a fondo el tema anterior, no dude en preguntar Dr. Alex Jiménez, DC, o póngase en contacto con nosotros en 915-850-0900.
Estamos aquí para ayudarlo a usted y a su familia.
Bendiciones
El Dr. Alex Jimenez corriente continua MSACP, enfermero*, CCCT, IFMCP*, CIFM*, ATN*
email: coach@elpasomedicinafuncional.com
Licenciado como Doctor en Quiropráctica (DC) en Texas & New Mexico*
Número de licencia de Texas DC TX5807, Nuevo México DC Número de licencia NM-DC2182
Licenciada como enfermera registrada (RN*) in Florida
Licencia de Florida Licencia de RN # RN9617241 (Control No. 3558029)
Estado compacto: Licencia multiestatal: Autorizado para ejercer en 40 Estados*
Dr. Alex Jiménez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mi tarjeta de presentación digital






