Después de la sección del nervio periférico de la extremidad superior y la reparación quirúrgica, algunos pacientes recuperan una buena función sensitivomotora mientras que otros no. Comprender los mecanismos periféricos y centrales que contribuyen a la recuperación puede facilitar el desarrollo de nuevas intervenciones terapéuticas. La plasticidad después de la sección del nervio periférico se ha demostrado a lo largo del neuroeje en modelos animales de lesión nerviosa. Sin embargo, no se han examinado los cambios cerebrales que ocurren después de la sección del nervio periférico y la reparación quirúrgica en humanos. Además, no se ha caracterizado hasta qué punto la regeneración de los nervios periféricos influye en los cambios funcionales y estructurales del cerebro. Por lo tanto, preguntamos si los cambios funcionales van acompañados de cambios estructurales en la sustancia gris y / o blanca y si estos cambios se relacionan con la recuperación sensorial. Para abordar estos problemas clave, (i) evaluamos la regeneración de nervios periféricos; (ii) activación cerebral de formación de imágenes por resonancia magnética funcional medida (señal dependiente del nivel de oxígeno en sangre; BOLD) en respuesta a un estímulo vibrotáctil; (iii) examinó la plasticidad cerebral estructural de la materia gris y blanca; y (iv) medidas de recuperación sensorial correlacionadas con cambios de materia gris en pacientes con sección de nervio periférico y reparación quirúrgica. En comparación con el nervio contralesional sano de cada paciente, los nervios seccionados tienen una conducción nerviosa alterada 1.5 años después de la sección y reparación, conduciendo con una amplitud disminuida y una latencia aumentada. En comparación con los controles sanos, los pacientes con sección de nervios periféricos y reparación quirúrgica tenían una actividad de señal dependiente del nivel de oxígeno en sangre alterada en las cortezas somatosensoriales primarias y secundarias contralesionales, y en un conjunto de áreas cerebrales conocidas como la red de tarea positiva. Además, se identificaron reducciones de materia gris en varias áreas del cerebro, incluidas las cortezas somatosensoriales primarias y secundarias contralesionales, en las mismas áreas donde se identificaron reducciones de señal dependientes del nivel de oxígeno en sangre. Además, el adelgazamiento de la materia gris en la circunvolución poscentral se correlacionó negativamente con las medidas de recuperación sensorial (detección mecánica y de vibraciones), lo que demuestra un vínculo claro entre la función y la estructura. Finalmente, identificamos una reducción de la anisotropía fraccional de la materia blanca en la ínsula derecha en una región que también demostró una reducción de la materia gris. Estos resultados proporcionan información sobre la plasticidad cerebral y las relaciones estructura-función-comportamiento después de una lesión nerviosa y tienen importantes implicaciones terapéuticas.
Palabras llave: espesor cortical; fMRI; imágenes de tensor de difusión; plasticidad; lesión del nervio periférico
Abreviaturas: BA = área de Brodmann; NEGRITA = dependiente del nivel de oxígeno en la sangre; fMRI = resonancia magnética funcional;
PNIr = transección del nervio periférico y reparación quirúrgica; S1 = corteza somatosensorial primaria; S2 = corteza somatosensorial secundaria
Contenido
Introducción
Después de la sección del nervio periférico del miembro superior y la reparación quirúrgica (PNIr), aproximadamente el 25% de los pacientes no han regresado al trabajo 1.5 años después de la cirugía (Jaquet et al., 2001). Además,? 57% de los pacientes con lesiones nerviosas tienen entre 16 y 35 años de edad (McAllister et al., 1996); por lo tanto, una larga vida de discapacidad y dificultades económicas pueden acompañar a la sección del nervio del miembro superior. La comprensión de las ramificaciones centrales y periféricas de la lesión del nervio periférico puede facilitar el desarrollo de nuevas estrategias terapéuticas y programas de intervención.
No se sabe cómo responde el cerebro a PNIr en humanos. Sin embargo, los estudios en animales han establecido que la plasticidad dentro de la corteza somatosensorial comienza inmediatamente después de la transección del nervio periférico, y que 1 año después de la transección completa del nervio y la reparación quirúrgica, los mapas corticales contienen representaciones irregulares discontinuas de los nervios transeccionados y adyacentes (Wall et al. ., 1986). Se cree que los mecanismos que facilitan la plasticidad funcional incluyen el desenmascaramiento inmediato de las proyecciones preexistentes de los niveles corticales y subcorticales adyacentes, y la germinación a largo plazo de los axones en múltiples niveles del neuroaxis, incluida la corteza somatosensorial primaria (S1) (Florence and Kaas , 1995; Hickmott y Steen, 2005).
Los estudios de imágenes del cerebro humano han corroborado los hallazgos de modelos animales con la identificación de mapas de activación de MRI funcionales alterados debido a lesión de la médula espinal, amputación, transferencia dedo a dedo y en pacientes con síndrome del túnel carpelo (Lotze et al., 2001; Manduch et al., 2002; Jurkiewicz y col., 2006; Napadow et al., 2006). Además, los estudios estructurales de MRI han visualizado recientemente cambios de materia gris y blanca después de lesiones traumáticas y en diversas condiciones patológicas, que incluyen amputación de extremidades y dolor crónico (Apkarian y col., 2004; Draganski y col., 2006; Davis y col., 2008; Geha y otros, 2008; May, 2008). Se cree que los cambios de la sustancia gris están relacionados con cambios en el tamaño celular, atrofia y / o pérdida de neuronas o glía, mientras que los cambios en la sustancia blanca se ven afectados por la degeneración axonal y la pérdida de mielina (Beaulieu, 2002; May, 2008).
Un enfoque poderoso para delinear los mecanismos de la patología y la plasticidad es combinar técnicas de imágenes de la materia gris y blanca funcionales y estructurales. Anteriormente informamos que los pacientes con PNIr de extremidad superior completa conservan profundos déficits somatosensitivos que persisten 41.5 años después de la cirugía (Taylor et al., 2008a). Con base en estos hallazgos, razonamos que estos pacientes exhibirían cambios cerebrales funcionales y estructurales en áreas clave del cerebro somatosensorial. Por lo tanto, en este estudio, planteamos la hipótesis de que los pacientes PNIr tendrían: (i) respuestas reducidas del nivel de oxígeno sanguíneo (BOLD) a la estimulación vibratoria del territorio del nervio seccionado, en la región de S1 que representa la extremidad superior lesionada y en la secundaria corteza somatosensorial (S2); (ii) una reducción correspondiente en el espesor cortical en estas regiones de S1 y S2 contralesionales; (iii) una correlación entre los cambios en el espesor cortical y las mediciones psicofísicas de la función somatosensorial (umbrales de detección de vibración y contacto); y (iv) anisotropía fraccional reducida (una medida de la integridad de la sustancia blanca) en la materia blanca que alimenta hacia adentro / hacia afuera de estas áreas corticales somatosensoriales.
Métodos
Materias
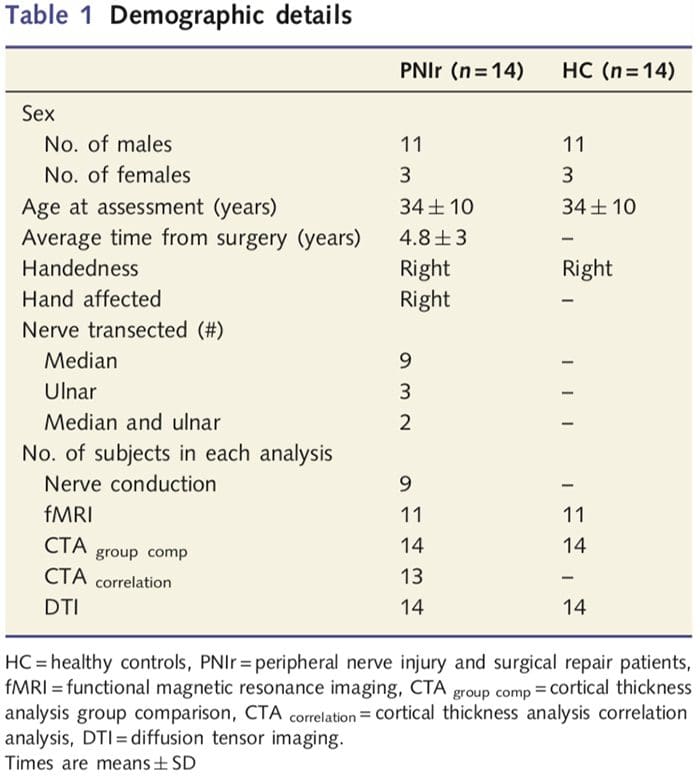
Reclutamos a 27 pacientes con una sección completa del nervio mediano y / o cubital seguida de reparación quirúrgica por parte de cirujanos plásticos afiliados al Programa de Mano de la Universidad de Toronto entre junio de 2006 y mayo de 2008. De esta cohorte más grande, 14 pacientes sin dolor , 11 varones; 34? 10 años) con sección completa del nervio mediano y / o cubital derecho fueron incluidos en el estudio [para evitar confusiones relacionadas con la presencia de dolor y lateralidad pacientes con dolor (n = 6) y lesiones del lado izquierdo (n = 7) fueron excluidos de este análisis]. Todos los pacientes se sometieron a reparación microquirúrgica del nervio al menos 1.5 años antes de la inscripción en el estudio (el tiempo de recuperación varió de 1.5 a 8 años). Además, reclutamos 14 controles sanos emparejados por edad y sexo (3 mujeres, 11 hombres; 34? 10 años). Todos los sujetos dieron su consentimiento informado por escrito a los procedimientos aprobados por la Junta de Ética en Investigación de la Red de Salud de la Universidad. Todos los sujetos eran diestros (determinado mediante el Inventario de lateralidad de Edimburgo: Oldfield, 1971) y no tenían antecedentes de lesión neurológica o dolor crónico (ni antes ni después de la sección del nervio). Consulte la Tabla 1 para obtener detalles demográficos.
Diseño del estudio
Todos los sujetos participaron en una sesión de imágenes que incluyó: (i) resonancia magnética funcional (fMRI) en respuesta a estímulos vibrotáctiles aplicados al dedo índice derecho (dentro del territorio del nervio mediano); (ii) una exploración anatómica de alta resolución de todo el cerebro, adquirida para el registro de imágenes y para el análisis de la materia gris cortical; y (iii) dos escaneos de imágenes de tensor de difusión para la evaluación de la integridad de la materia blanca. Antes de la obtención de imágenes, se instruyó a los sujetos en el diseño básico del experimento y se les recordó que permanezcan lo más quietos posible durante todo el análisis.
Los sujetos fueron libres de retirarse del estudio en cualquier momento. Además, se realizó una evaluación sensorial y motora para todos los sujetos (Taylor et al., 2008a). Como los umbrales de detección de contacto y vibración se correlacionaron con el grosor cortical, a continuación se incluye una descripción de estos métodos (otras medidas psicofísicas se informarán en otro lugar).
Umbral de vibración
Los umbrales de detección de vibraciones se determinaron usando un Bio-Thesiometer portátil (Bio-Medical Instrument Company, EE. UU.). El dispositivo tiene una sonda 12-mm que se colocó en la falange distal del dedo índice derecho (D2). Los umbrales se determinaron usando el método de límites: la amplitud (voltaje) se incrementó gradualmente hasta que el sujeto indicó que percibían el estímulo. Los umbrales de vibración se adquirieron tres veces y se calculó un valor promedio. Durante la prueba del umbral de vibración, se instruyó a los sujetos a cerrar los ojos y apoyar la parte posterior de la mano sobre un cojín de apoyo.
Umbral de detección mecánica
Los umbrales de detección mecánica se determinaron utilizando un conjunto estandarizado de filamentos de von Frey (OptiHair2 Marstock Nervtest, Alemania) que contiene 12 filamentos calibrados espaciados logarítmicamente que suministran fuerzas desde 0.25-512 mN. El diámetro de la superficie de contacto de los 12 filamentos fue de ~ 0.4 mm. Las pruebas se realizaron con los ojos del sujeto cerrados y las manos descansando sobre un cojín suave. Las sondas se aplicaron en una serie ascendente y se pidió a los sujetos que respondieran cada vez que sintieran que una sonda tocaba la punta del dedo D2 derecho. Este proceso se repitió tres veces. La fuerza del filamento que se detectó en al menos dos de tres ensayos se informó como el umbral de detección mecánica de ese sujeto.
Pruebas de conducción nerviosa
Los pacientes participaron en estudios bilaterales de conducción nerviosa sensitiva y motora en la clínica de electromiografía (EMG) del Toronto Western Hospital. Para la conducción del nervio motor, el electrodo estimulante se colocó en la muñeca y el codo (por separado) y el electrodo de registro se colocó sobre el abductor corto del pulgar, para la evaluación del nervio mediano, o el abductor digiti minimi para la evaluación del nervio cubital. Para la prueba del nervio sensorial, el electrodo de registro se colocó en la muñeca y el electrodo de estimulación se colocó en los dígitos D2, D3 y D5. Un neurólogo experimentado de la Clínica EMG del Toronto Western Hospital (Dr. Peter Ashby) revisó todas las evaluaciones clínicas para determinar qué nervios demostraron respuestas normales / anormales. Como se sabe que las medidas de amplitud y latencia varían sustancialmente entre los sujetos (debido a factores tales como la densidad de inervación, la profundidad del nervio y el grosor de la piel de un sujeto individual) (Kimura, 2001) el nervio no seccionado de cada paciente sirvió como su propio control para la comparación con los valores del lado seccionado. En aquellos pacientes con respuestas de conducción nerviosa detectables, se realizaron pruebas t pareadas para evaluar la diferencia en las medidas de latencia o amplitud entre los nervios transeccionados y no transeccionados contralesionales de cada paciente.
Parámetros de imagen
Los datos de imágenes cerebrales se adquirieron utilizando un sistema de resonancia magnética 3T GE equipado con una bobina de cabezal de matriz en fase de ocho canales. Los sujetos se colocaron en decúbito supino sobre la mesa de resonancia magnética y la cabeza de cada sujeto se acolchó para reducir el movimiento. Los datos de resonancia magnética funcional de todo el cerebro se adquirieron mediante ecografía planar (28 cortes axiales, campo de visión (FOV) = 20 x 20 cm, matriz de 64 x 64, vóxeles de 3.125 x 3.125 x 4 mm, tiempo de eco (TE) = 30 ms, repetición tiempo (TR) = 2000 ms). El tiempo de exploración fue de 5 min y 8 s (154 fotogramas). Durante la exploración, se aplicó un estímulo vibrotáctil de 12 Hz no doloroso a la falange distal del D2 derecho utilizando diafragmas de globo impulsados por aire comprimido (Dispositivo fabricado por el Dr. Christo Pantev; www.biomag.uni-muenster.de). Los estímulos se entregaron en bloques de 10 intercalados con 20 de descanso, para un total de 10 bloques de estimulación y 10 bloques de descanso. Los primeros 8 s (4 TR) de datos adquiridos de cada ejecución se descartaron para permitir el equilibrio de la señal de fMRI. Se indicó a los sujetos que mantuvieran los ojos cerrados durante el escaneo y que se concentraran en los estímulos. Se adquirió una exploración anatómica de alta resolución tridimensional (3D) de todo el cerebro (124 cortes sagitales, FOV de 24 x 24 cm, matriz de 256 x 256, vóxeles de 1.5 x 0.94 x 0.94 mm) con una secuencia de eco de gradiente estropeado 1D ponderado en T3 (promedio de una señal, ángulo de volteo = 20?, TE? 5 ms). Además, se adquirieron dos exploraciones de imágenes con tensor de difusión (38 cortes axiales, FOV 24 x 24 cm, matriz de 128 x 128, vóxeles de 1.875 x 1.875 x 3 mm) a lo largo de 23 direcciones con un valor b de 1000 mm2. Cada ejecución también contenía dos volúmenes sin ponderación de difusión.
Análisis de fMRI
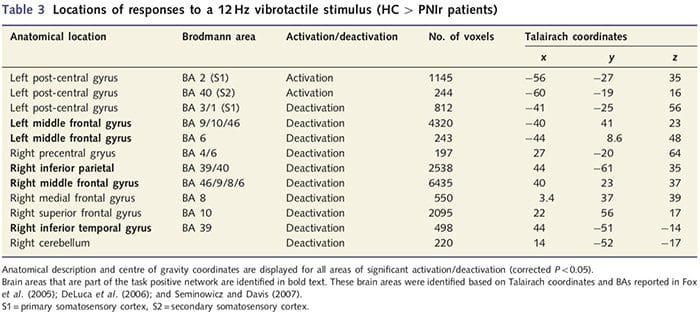
Los datos se analizaron usando Brainvoyager QX v1.8 (Brain Innovaton, Maastricht, Holanda). El preprocesamiento incluyó: corrección de movimiento 3D, corrección del tiempo de escaneo de corte, eliminación de tendencia lineal, filtrado de paso alto (cinco ciclos por ejecución) y suavizado espacial con un núcleo gaussiano 6mm de ancho completo a la mitad del máximo (FWHM). Los conjuntos de datos de fMRI se interpolaron a los vóxeles xNUMX x 3 x 3 mm, se registraron en la imagen anatómica de alta resolución y se normalizaron en el espacio Talairach estándar (Talairach y Tournoux, 3). Los vóxeles se informan como 1988 x 1 x 1 mm. Los datos se analizaron usando el modelo lineal general; el modelo se obtuvo al convolucionar la función del vagón de caja del curso temporal de la estimulación táctil con la función de respuesta hemodinámica estándar. Para identificar las diferencias entre los grupos en los patrones de activación, se realizó un análisis de efectos fijos con los contrastes: (i) controles sanos: estimulación 1 reposo; (ii) PNIr: estimulación 4 resto; y (iii) controles sanos 4 PNIr. Los mapas de activación se midieron con un umbral en un valor corregido de P4 (derivado de un P50.05 no corregido y 50.0001mm120 contiguo vóxeles como se informó anteriormente: Taylor y Davis, 3); esto también se validó ejecutando una simulación Monte Carlo con la aplicación AlphaSim implementada en el software Analysis of Functional Neuroimage (AFNI). Este análisis incluyó solo a los pacientes 2009 que sostuvieron la sección del nervio mediano derecho (n = 11) o la mediana derecha y el nervio cubital (n = 9) (es decir, los tres pacientes con una transección del nervio cubital derecho puro no se incluyeron en este análisis )
Análisis de espesor cortical
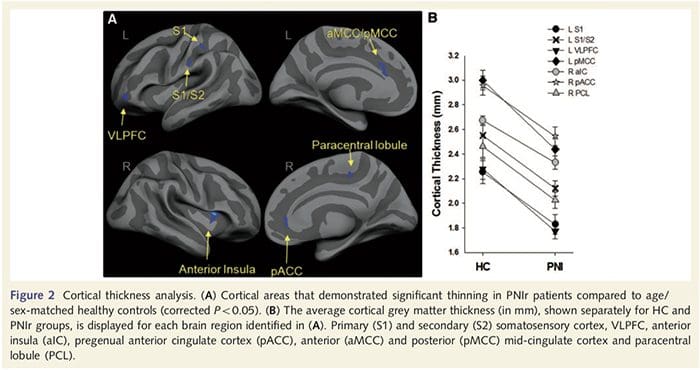
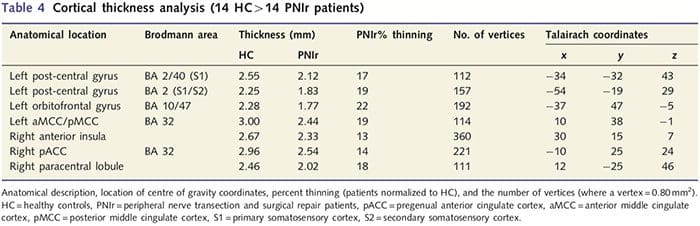
El análisis del espesor cortical se realizó con Freesurfer (http: // surfer.nmr.mgh.harvard.edu); Los métodos se han descrito en detalle en otra parte (Dale et al., 1999; Fischl et al., 1999a, b; Fischl y Dale 2000). Brevemente, los conjuntos de datos anatómicos ponderados en T1 de alta resolución se registraron en el atlas de Talairach (Talairach y Tournoux, 1988). A esto le siguió la normalización de la intensidad, la extracción del cráneo y la separación de los hemisferios. Posteriormente, se identificaron y segmentaron los límites de materia blanca / gris (denominada superficie blanca) y gris / CSF (denominada superficie pial). A continuación, se calculó la distancia entre las superficies blanca y pial en cada punto de cada hemisferio del cerebro. Para identificar las diferencias de grupo entre los 14 pacientes y los 14 controles emparejados por edad / sexo, se realizó un análisis de modelo lineal general en cada punto del cerebro. Como la topografía cortical del individuo es intrínsecamente heterogénea, se aplicó un núcleo de suavizado espacial FWHM de 5 mm antes del análisis estadístico. Los datos se muestran en un P50.05 corregido (derivado de un P50.0075 sin corregir y 102 vértices contiguos); esto se calculó ejecutando una simulación de Monte Carlo con AlphaSim. Un vértice representa un punto en una hoja bidimensional y, en este estudio, la distancia entre dos vértices es 0.80 mm2.
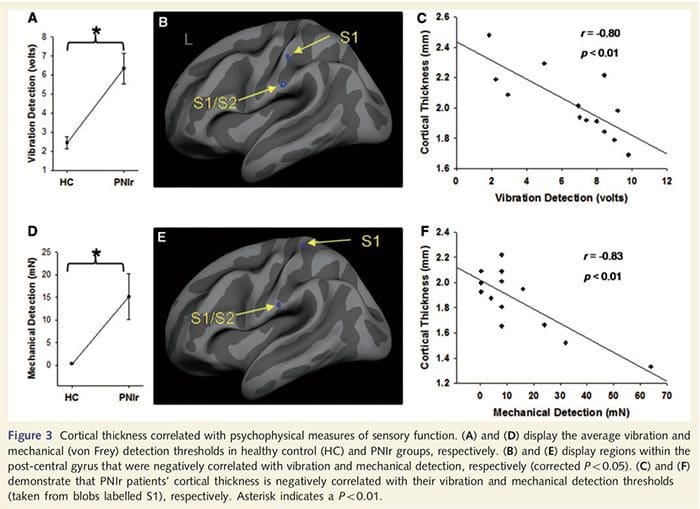
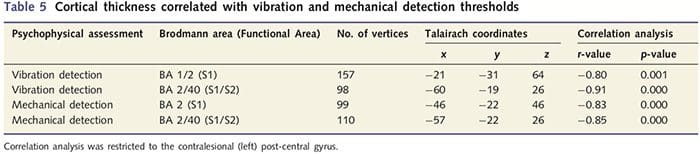
Como los pacientes exhibían déficits significativos en la función somatosensorial dentro del territorio del nervio seccionado, planteamos la hipótesis de que las medidas de la función somatosensorial (detección de vibración y tacto) se correlacionarían con el grosor cortical en la circunvolución poscentral contralesional (cortezas somatosensoriales primarias y secundarias). Por lo tanto, realizamos análisis de correlación en el grupo de pacientes entre: (i) espesor cortical y umbral de detección de vibraciones; y (ii) el espesor cortical y los umbrales de detección del tacto. Un paciente no completó la evaluación psicofísica; por lo tanto, este análisis incluyó a 13 pacientes con PNIr. Además, para determinar si existía una relación entre el grosor cortical y el tiempo de recuperación, también se realizó un análisis de correlación entre estas dos medidas. Estos análisis de correlación se restringieron al giro poscentral contralesional al incluir una máscara (tomada del atlas integrado de Freesurfer) en el modelo lineal general. Se realizó una simulación de Monte Carlo que se restringió al número de vértices dentro de la circunvolución contralesional poscentral; las imágenes se muestran con un P50.05 corregido (derivado de un P50.0075 sin corregir y 68 vértices contiguos).
Análisis de imágenes del tensor de difusión
El procesamiento de imágenes del tensor de difusión se realizó con DTiStudio (www.MriStudio.org) y FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/). Las imágenes se reajustaron primero con la herramienta de registro automático de imágenes implementada en DTiStudio, utilizando la primera imagen B0 de la primera serie adquirida como plantilla. Este proceso corrige el movimiento del sujeto y la distorsión de las corrientes parásitas. A continuación, todas las imágenes se inspeccionaron visualmente para evaluar la calidad de la imagen y la alineación de las series de imágenes del tensor de difusión separadas. Si se detectaba un artefacto, se retiraba el corte antes de calcular el promedio de las dos ejecuciones de imágenes del tensor de difusión por separado. Los mapas de FA individuales se calcularon utilizando la herramienta DTIFIT implementada en FSL. Se realizó un análisis estadístico de vóxeles para identificar diferencias de grupo en la anisotropía fraccional media utilizando estadísticas espaciales basadas en tractos; para una descripción completa de estos métodos, véase Smith et al. (2006). Brevemente, las imágenes se registraron de forma no lineal en una imagen de destino (MNI152), la imagen media se creó a partir de todos los conjuntos de datos y esta imagen se redujo posteriormente para representar todos los tractos que eran comunes a todos los sujetos. Los valores de anisotropía fraccional más altos de cada sujeto se proyectaron luego en el esqueleto mediante la búsqueda en materia blanca perpendicular a cada punto del esqueleto de materia blanca. A continuación, se realizó un análisis estadístico de voxel de todo el cerebro entre los grupos (14PNIr y 14 controles sanos) y se corrigieron las imágenes de todo el cerebro a P50.05. Además, se realizó un análisis de región de interés en materia blanca extensiones adyacente al S1 contralateral, tálamo y ínsula bilateral anterior y posterior. Estas regiones se eligieron como se han implicado previamente en aspectos de somatosensación y porque se corresponden con las regiones que se identificaron en los análisis de grupo de análisis de espesor cortical (IRM) y fMRI. Las regiones de interés se dibujaron sobre el esqueleto de materia blanca de la siguiente manera: (i) La región de interés S1 contralateral se originó medialmente en la unión entre el esqueleto de materia blanca de la corona radiata y la sección del esqueleto que alimenta la circunvolución poscentral; terminando al final del tramo dentro de un segmento dado.
En la dirección z, la región de interés se extendió desde z = 49 a 57; tractos de materia blanca que irrigan la región de la mano. (ii) La región del tálamo contralateral de interés se restringió a las pistas de materia blanca que rodean los núcleos talámicos posterior y medial (núcleos involucrados en la función somatosensorial), que se extienden desde z = 1 a 4. (iii) Las regiones insulares de interés se dibujaron bilateralmente dentro materia blanca adyacente a la ínsula anterior y posterior según los criterios previamente publicados por nuestro laboratorio (Taylor et al., 2008b). La región de interés se extendió de z = 2 a 8. Se extrajeron valores de anisotropía fraccional de cada una de estas regiones de interés y se realizó un análisis multivariado de varianza (MANOVA) utilizando el paquete estadístico para las ciencias sociales v13.0 (SPSS Inc, Chicago), que incluyó valores de anisotropía fraccional para las seis regiones de interés.
Resultados
La Tabla 1 proporciona detalles demográficos para los participantes del estudio. Los 14 pacientes sufrieron una sección completa del nervio mediano y / o cubital derecho seguida de reparación microquirúrgica al menos 1.5 años antes de la inscripción en el estudio. El tiempo desde la cirugía hasta la prueba osciló entre 1.5 y 8 años con una media (? DE) de 4.8? 3 años. Los pacientes y los controles no lo hicieron (34? 10 años ambos grupos; t = 0.04; P = 0.97).
Psicofísica
Los umbrales de vibración se calcularon a partir de las tres mediciones ya que el análisis de varianza de medidas unidireccionales (ANOVA) no indicó diferencias significativas entre los tres ensayos [F (25, 1) = 0.227, P = 0.64]. Los umbrales de detección mecánica y de vibración se vieron perjudicados significativamente en pacientes PNIr en comparación con controles sanos (vibración: t = 4.77, P50.001, Fig. 3A; mecánica: t = 3.10, P = 0.005, Fig. 3D).
Pruebas de conducción nerviosa
Las medidas de amplitud y latencia obtenidas de los nervios contralesionales de cada paciente fueron clasificadas como normales por un neurólogo experimentado en la Clínica EMG del Toronto Western Hospital. Nueve de los 14 pacientes completaron las pruebas de conducción nerviosa. La Tabla 2 muestra los datos de amplitud y latencia promedio de aumento / disminución para la conducción nerviosa sensorial desde la muñeca hasta los músculos abductor corto del pulgar (mediana) o abductor digiti minimi (cubital) y para la conducción sensorial desde la muñeca hasta D2 (mediana) y D5 ( cubital) en comparación con el nervio contralesional ileso de cada paciente. De nueve, siete pacientes tuvieron transecciones que incluyeron el nervio mediano. De estos siete, un paciente no tuvo una respuesta detectable durante la prueba motora y otro paciente no tuvo una respuesta detectable durante la prueba sensorial.
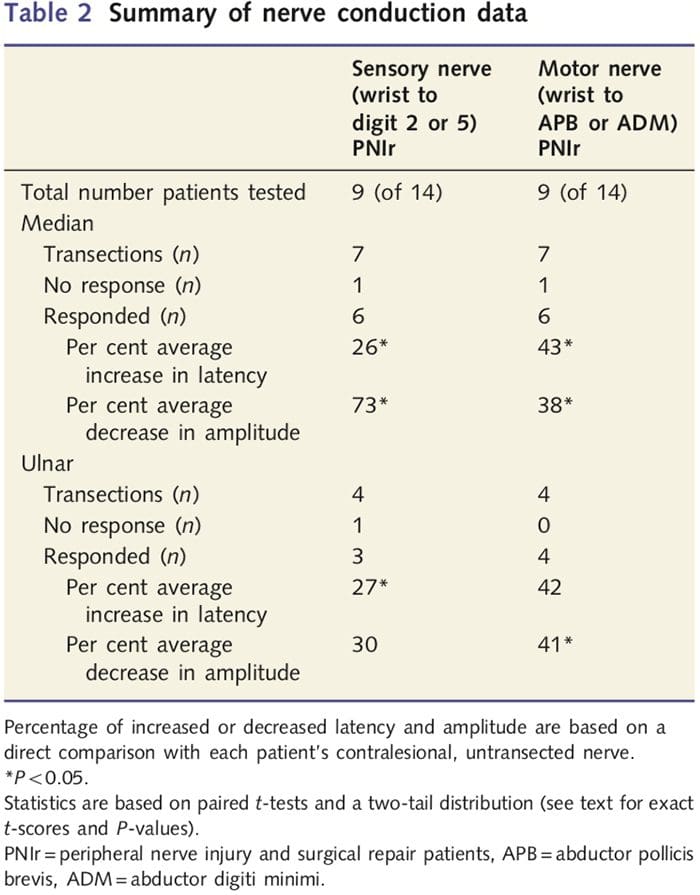 En los seis pacientes con respuestas detectables, las latencias de conducción motora aumentaron en un 43% (t = 6.2; P = 0.002) y las amplitudes disminuyeron en un 38% (t = 2.6; P = 0.045) cuando se cortó el nervio transectado de cada paciente. en comparación con su lado no lesionado. La conducción sensorial en los nervios medianos también reveló un aumento del 26% en la latencia (t = 3.9; P = 0.011) y una disminución del 73% en la amplitud (t = 8.0; P = 0.000) en comparación con los nervios contralesionales normales. En los cuatro pacientes con transecciones del nervio cubital, un paciente no tuvo una respuesta detectable durante la prueba del nervio sensorial. En aquellos pacientes con respuestas, las latencias motoras del nervio cubital no se elevaron significativamente (t = 2.8; P = 0.070); sin embargo, las amplitudes fueron significativamente
En los seis pacientes con respuestas detectables, las latencias de conducción motora aumentaron en un 43% (t = 6.2; P = 0.002) y las amplitudes disminuyeron en un 38% (t = 2.6; P = 0.045) cuando se cortó el nervio transectado de cada paciente. en comparación con su lado no lesionado. La conducción sensorial en los nervios medianos también reveló un aumento del 26% en la latencia (t = 3.9; P = 0.011) y una disminución del 73% en la amplitud (t = 8.0; P = 0.000) en comparación con los nervios contralesionales normales. En los cuatro pacientes con transecciones del nervio cubital, un paciente no tuvo una respuesta detectable durante la prueba del nervio sensorial. En aquellos pacientes con respuestas, las latencias motoras del nervio cubital no se elevaron significativamente (t = 2.8; P = 0.070); sin embargo, las amplitudes fueron significativamente
disminuyó en un 41% (t = 5.9; P = 0.010). Las pruebas sensoriales del nervio cubital demostraron un aumento del 27% en la latencia (t = 4.3; P = 0.049) pero ningún aumento significativo en la amplitud (t =? 3.5; P = 0.072).
Plasticidad funcional en la corteza somatosensorial primaria
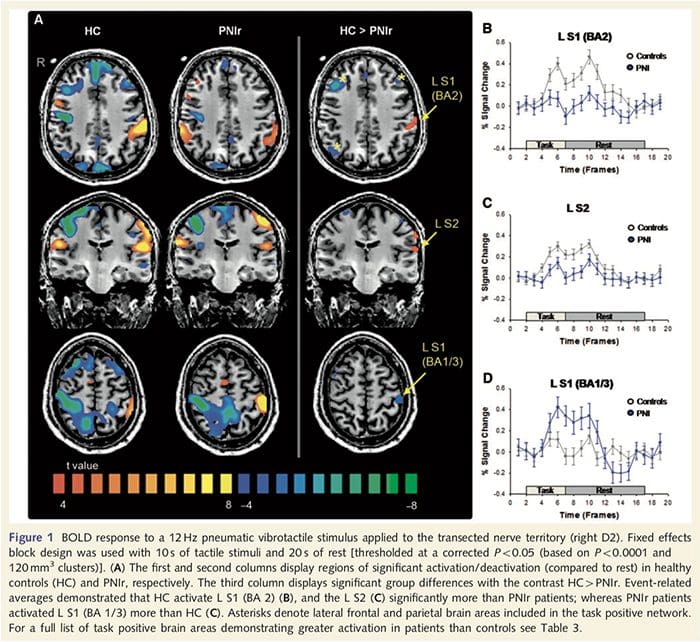
Los mapas de resonancia magnética funcional se calcularon a partir de los 11 pacientes PNIr con transecciones del nervio mediano derecho (los pacientes con transecciones del nervio cubital se excluyeron de este análisis) y 11 controles sanos emparejados por edad y sexo. De la Fig. 1A, está claro que los pacientes con PNIr tienen una activación significativamente menor, en comparación con los controles sanos, en una región de S1 correspondiente al área 2 de Brodmann (BA2) (Talairach y Tournoux, 1988) y S2 (ver la Tabla 3 para más detalles) . Las respuestas promedio relacionadas con el evento de estas regiones de interés resaltan la respuesta BOLD atenuada dentro de los pacientes izquierda BA2 y izquierda S2 (Fig. 1B y C, respectivamente). Curiosamente, la estimulación vibrotáctil en los pacientes activó una parte más superior de la circunvolución poscentral (probablemente BA1 / 3) (Talairach y Tournoux, 1988) (Fig. 1A y Tabla 3). Un promedio relacionado con eventos (Fig. 1D) demuestra que los controles sanos tenían una activación mínima en esta región. Además, los pacientes tenían una activación significativamente mayor en las regiones del cerebro conocidas colectivamente como red de tareas positivas (asteriscos en la figura 1). Consulte la Tabla 3 para obtener la lista completa de las áreas cerebrales positivas para tareas activadas. Esta red incluye cortezas lateral prefrontal, lateral parietal, premotora y temporal inferior (Tabla 3): áreas cerebrales que se activan durante la realización de una tarea que exige atención y se suprimen o inactivan durante el descanso o tareas que no son cognitivas o atencionales desafiantes (Fox et al. al., 2005; DeLuca et al., 2006; Seminowicz y Davis 2007).
La materia gris reducida en la corteza somatosensorial primaria se correlaciona con la recuperación sensorial
El análisis del espesor cortical en los 14 pacientes y 14 controles sanos emparejados por edad / sexo reveló varios loci de adelgazamiento cortical significativo en el grupo PNIr (Fig. 2 y Tabla 4). Específicamente, los pacientes tuvieron una reducción del 13% -22% en el grosor cortical en la circunvolución del cíngulo anterior izquierdo (contralesional) S1, S2, la corteza prefrontal ventrolateral y la ínsula anterior derecha, la circunvolución del cíngulo medio anterior / posterior y el lóbulo paracentral. Curiosamente, las ubicaciones del adelgazamiento de la materia gris dentro de la circunvolución poscentral coinciden con las regiones de BOLD reducido después de la estimulación vibrotáctil (Tabla 4). Dado que teníamos conocimiento previo de los déficits sensoriales de los pacientes y el tiempo de recuperación (es decir, el tiempo desde la reparación microquirúrgica), a continuación preguntamos si el grosor cortical de los pacientes en la circunvolución poscentral se correlacionaba con sus umbrales sensoriales mecánicos y de detección de vibraciones, o con su tiempo de recuperación. Estos análisis revelaron una correlación negativa entre el grosor cortical y los umbrales de detección de vibraciones en una región que abarca BA1 / 2 y S2 (P50.001, r =? 0.80 y? 0.91, para BA1 / 2 y S2, respectivamente; Fig.3 y Tabla 5 ). Además, los umbrales de detección mecánica también se correlacionaron negativamente con el grosor cortical en una región BA2 ligeramente más superior y la misma región S2 (P50.001, r =? 0.83 y? 0.85, para BA2 y S2, respectivamente; Fig.3 y Tabla 5). Sin embargo, no identificamos una relación significativa entre el tiempo de recuperación y el grosor cortical. Por lo tanto, en la circunvolución poscentral, el adelgazamiento cortical se asoció con déficits sensoriales más graves. Sin embargo, no identificamos una relación significativa entre el tiempo de recuperación y el grosor cortical. Una vez más, hubo una correspondencia entre el adelgazamiento cortical en áreas correlacionadas negativamente con los estímulos vibratorios y las regiones que mostraban anomalías de grupo de resonancia magnética funcional y de ATC.
Anomalías de la materia blanca después de la sección del nervio
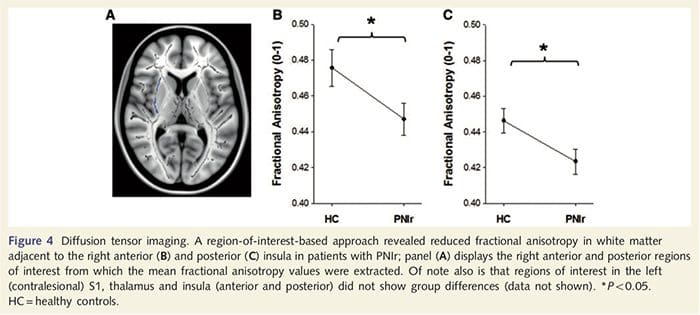
Para evaluar la integridad de la materia blanca, utilizamos un enfoque de región de interés para examinar las diferencias del grupo de la sustancia blanca sobre la base de hipótesis a priori. Las regiones de interés se restringieron a los tractos de sustancia blanca que rodeaban y alimentaban el S1 y el tálamo contralesionales. Además, también dibujamos regiones de interés en la materia blanca adyacente a la ínsula izquierda y derecha, anterior y posterior. La ínsula fue elegida ya que está implicada en el procesamiento somatosensorial y porque identificamos una reducción de la materia gris en la insular anterior derecha con CTA. Este enfoque de región de interés reveló que los pacientes tenían valores de anisotropía fraccional de sustancia blanca significativamente reducidos (MANOVA que incluye las seis regiones de interés) adyacentes al anterior derecho [F (1, 26) = 4.39, P = 0.046; Fig. 4A] e ínsula posterior [F (1, 26) = 5.55, P = 0.026; Fig. 4B], pero no hubo diferencias de grupo en la sustancia blanca adyacente a la ínsula izquierda (ínsula anterior izquierda: P = 0.51, ínsula posterior izquierda: P = 0.26), tálamo (P = 0.46) o S1 (P = 0.46 )
 Discusión
Discusión
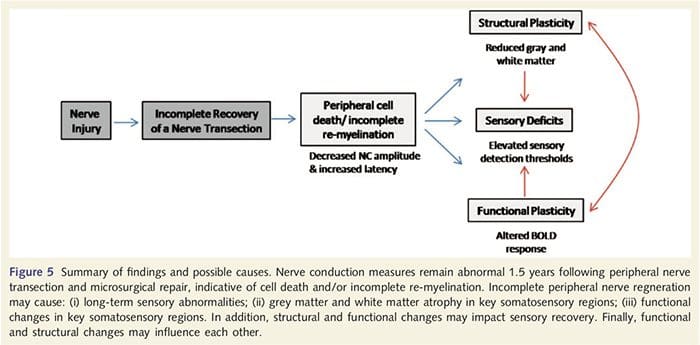
Aquí, hemos demostrado por primera vez que hay plasticidad funcional y anomalías estructurales de la materia gris y blanca en varias áreas corticales después de la transección del nervio periférico de la extremidad superior y la reparación quirúrgica. Esta plasticidad puede surgir a partir de la regeneración incompleta del nervio periférico (muerte celular periférica y reeliminación incompleta), ya que las medidas de conducción nerviosa en estos pacientes demostraron anormalidades graves. Además, nuestros datos demuestran que la disminución de las respuestas de fMRI inducidas por vibrotactilia en la circunvolución central posterior se corresponde con el adelgazamiento de la sustancia gris en el grupo de pacientes. Estos resultados sugieren que las respuestas BOLD reducidas pueden ser facilitadas por una reducción en la materia gris cortical y / o una disminución en la entrada aferente a la circunvolución poscentral. Además, el grosor cortical dentro de estas mismas partes de la circunvolución poscentral se correlacionó negativamente con las medidas conductuales de la función somatosensorial. Es decir, el aumento de los déficits somatosensitivos se correlacionó con la corteza más delgada; ambos pueden estar relacionados con la entrada aferente. Tomados en conjunto, nuestros datos sugieren que la regeneración incompleta del nervio periférico contribuye a alteraciones somatosensoriales, atrofia de la sustancia gris cortical y activación de fMRI reducida (para un resumen de estos hallazgos, véase la Fig. 5).
Es bien sabido que la plasticidad cortical después de la transección del nervio periférico y la reparación quirúrgica pueden ocurrir en todo el SNC en primates no humanos (Kaas, 1991). Se cree que esta plasticidad se debe al desenmascaramiento de sinapsis previamente silenciosas o brotación axonal en territorio sordorado (Wall et al., 1986, Florence y Kaas, 1995). En el modelo de primates, 1 año después de la transección del nervio y la reparación quirúrgica, la corteza denervada se caracteriza por representaciones incompletas y desordenadas de los nervios regenerados y adyacentes (intactos). Esta representación en parches se atribuye a la regeneración periférica incompleta que da como resultado una recuperación parcial del espacio cortical denervado (Kaas, 1991). Para evaluar el grado de regeneración periférica en nuestra población de pacientes realizamos estudios de conducción nerviosa sensorial y motora a través del área transeccionada. Nuestros resultados de conducción nerviosa demuestran que los pacientes PNIr tienen una amplitud significativamente disminuida y una latencia aumentada en los nervios sensoriales y motores en comparación con su propio lado no extraído. La disminución de la amplitud combinada con una latencia incrementada es indicativa de pérdida de fibra periférica (es decir, muerte celular) y / o re-mielinización anormal o incompleta después de la sección (Kimura, 1984). Además, está bien establecido que entre 20% y 50% de las neuronas del ganglio de la raíz dorsal mueren después de la transección del nervio (Liss et al., 1996). Por lo tanto, la muerte celular aferente y la regeneración incompleta pueden dar como resultado una entrada aferente disminuida en la corteza, lo que puede explicar los déficits sensoriales continuados y la disminución de la respuesta BOLD en BA2 y S2. Además, esta entrada aferente disminuida también podría explicar el adelgazamiento cortical que observamos en las mismas regiones de la corteza. Se ha demostrado que la privación sensorial causa degeneración transneuronal en varias regiones del SNC, incluido el cuerno dorsal después de la sección del nervio ciático (Knyihar-Csillik y cols., 1989), y puede implicar neuronas de segundo y tercer orden (Powell y cols. Erulkar, 1962). La degeneración transneuronal se caracteriza por la contracción celular y se cree que está relacionada con la entrada aferente disminuida o inexistente (Knyihar-Csillik et al., 1989). Por lo tanto, la pérdida (o atrofia) de la sustancia gris cortical también podría estar directamente relacionada con una entrada aferente disminuida.
 También demostramos una mayor activación en la circunvolución central posterior en una región correspondiente a BA1 / 3 (Talairach y Tournoux, 1988). Los estudios electrofisiológicos, de rastreo anatómico y de neuroimagen han establecido que, para la mayoría de aferentes mecanoreceptoras cutáneas, los primeros destinos corticales son BA1 y BA3b. Estas áreas cerebrales citoarquitectónicas poseen un mapa somatotópico del cuerpo con pequeños campos receptivos. Además, estas áreas responden a muchas características de la información táctil, como la textura y la rugosidad, la velocidad y la curvatura de los estímulos (Bodegard et al., 2001). Los estudios de fMRI han demostrado que la actividad dentro de la corteza somatosensorial está influenciada por la atención de manera que las respuestas de fMRI a los estímulos táctiles en S1 aumentan cuando los sujetos atienden un estímulo táctil, pero se atienen cuando los sujetos se distraen (Arthurs et al. 2004; Porro y col., 2004). Además, nuestros pacientes activaron una red de áreas cerebrales conocida como red de tarea positiva (DeLuca et al., 2006) más que controles sanos. Estas áreas cerebrales se activan durante los procesos demandantes de atención (Fox et al., 2005, Seminowicz y Davis, 2007). En conjunto, estos hallazgos implican que los pacientes deben prestar más atención al estímulo que los controles debido a su insumo sensorial. Esta mayor atención también puede explicar la mayor activación en BA1 / 3b. Por supuesto, la mayor activación en BA1 / 3b también puede reflejar plasticidad que no está relacionada con la carga atencional.
También demostramos una mayor activación en la circunvolución central posterior en una región correspondiente a BA1 / 3 (Talairach y Tournoux, 1988). Los estudios electrofisiológicos, de rastreo anatómico y de neuroimagen han establecido que, para la mayoría de aferentes mecanoreceptoras cutáneas, los primeros destinos corticales son BA1 y BA3b. Estas áreas cerebrales citoarquitectónicas poseen un mapa somatotópico del cuerpo con pequeños campos receptivos. Además, estas áreas responden a muchas características de la información táctil, como la textura y la rugosidad, la velocidad y la curvatura de los estímulos (Bodegard et al., 2001). Los estudios de fMRI han demostrado que la actividad dentro de la corteza somatosensorial está influenciada por la atención de manera que las respuestas de fMRI a los estímulos táctiles en S1 aumentan cuando los sujetos atienden un estímulo táctil, pero se atienen cuando los sujetos se distraen (Arthurs et al. 2004; Porro y col., 2004). Además, nuestros pacientes activaron una red de áreas cerebrales conocida como red de tarea positiva (DeLuca et al., 2006) más que controles sanos. Estas áreas cerebrales se activan durante los procesos demandantes de atención (Fox et al., 2005, Seminowicz y Davis, 2007). En conjunto, estos hallazgos implican que los pacientes deben prestar más atención al estímulo que los controles debido a su insumo sensorial. Esta mayor atención también puede explicar la mayor activación en BA1 / 3b. Por supuesto, la mayor activación en BA1 / 3b también puede reflejar plasticidad que no está relacionada con la carga atencional.
 BA2 y S2 reciben proyecciones de BA1 / 3b y también de distintas partes del complejo talámico ventro-posterior (Pons et al., 1985, Friedman y Murray, 1986). Ambos cerebro las áreas tienen campos receptivos grandes, a menudo de varios dígitos (BA2) o bilaterales (S2) (Pons et al., 1985; Iwamura et al., 2002). Basado en proyecciones anatómicas y propiedades de respuesta neuronal, se ha demostrado el procesamiento jerárquico de la información táctil desde BA1 / 3b hasta BA 2 (Kaas et al., 2002). Además, los estudios electrofisiológicos en macacos (Pons et al., 1987) y los datos de magnetoencefalografía adquiridos en humanos, sugieren que el procesamiento en serie de entradas táctiles ocurre de S1 a S2 en primates superiores (Frot y Mauguiere 1999; Disbrow et al. ., 2001). Varios estudios han demostrado que BA2 se activa preferentemente por forma y curvatura (Bodegard et al., 2001), mientras que S2 puede estar involucrado en el aprendizaje táctil (Ridley y Ettlinger 1976; Murray y Mishkin, 1984), apoyando la noción de que estas áreas del cerebro están involucrados en el procesamiento somatosensorial de orden superior. Nuestra evaluación psicofísica demostró que los pacientes estaban significativamente deteriorados en la detección de estímulos táctiles simples y en la prueba de identificación de textura de forma 1.5 años después de la cirugía (Taylor et al., 2008a). Esta última prueba evalúa la capacidad del paciente para reconocer las características de un objeto mientras explora activamente una forma o textura, lo que requiere la integración de información sensorial en todas las regiones del cuerpo (Rosen y Lundborg, 1998). En conjunto, una interpretación de nuestros datos es que los pacientes con PNIr prestan más atención al estímulo vibrotáctil, lo que lleva a una mayor activación de la red positiva de la tarea y BA1 / 3. Sin embargo, en estos pacientes, nuestros datos implican que las áreas de procesamiento de orden superior, como BA2 y S2, no recibieron información táctil, lo que, a su vez, puede provocar un adelgazamiento cortical y una reducción de las respuestas BOLD.
BA2 y S2 reciben proyecciones de BA1 / 3b y también de distintas partes del complejo talámico ventro-posterior (Pons et al., 1985, Friedman y Murray, 1986). Ambos cerebro las áreas tienen campos receptivos grandes, a menudo de varios dígitos (BA2) o bilaterales (S2) (Pons et al., 1985; Iwamura et al., 2002). Basado en proyecciones anatómicas y propiedades de respuesta neuronal, se ha demostrado el procesamiento jerárquico de la información táctil desde BA1 / 3b hasta BA 2 (Kaas et al., 2002). Además, los estudios electrofisiológicos en macacos (Pons et al., 1987) y los datos de magnetoencefalografía adquiridos en humanos, sugieren que el procesamiento en serie de entradas táctiles ocurre de S1 a S2 en primates superiores (Frot y Mauguiere 1999; Disbrow et al. ., 2001). Varios estudios han demostrado que BA2 se activa preferentemente por forma y curvatura (Bodegard et al., 2001), mientras que S2 puede estar involucrado en el aprendizaje táctil (Ridley y Ettlinger 1976; Murray y Mishkin, 1984), apoyando la noción de que estas áreas del cerebro están involucrados en el procesamiento somatosensorial de orden superior. Nuestra evaluación psicofísica demostró que los pacientes estaban significativamente deteriorados en la detección de estímulos táctiles simples y en la prueba de identificación de textura de forma 1.5 años después de la cirugía (Taylor et al., 2008a). Esta última prueba evalúa la capacidad del paciente para reconocer las características de un objeto mientras explora activamente una forma o textura, lo que requiere la integración de información sensorial en todas las regiones del cuerpo (Rosen y Lundborg, 1998). En conjunto, una interpretación de nuestros datos es que los pacientes con PNIr prestan más atención al estímulo vibrotáctil, lo que lleva a una mayor activación de la red positiva de la tarea y BA1 / 3. Sin embargo, en estos pacientes, nuestros datos implican que las áreas de procesamiento de orden superior, como BA2 y S2, no recibieron información táctil, lo que, a su vez, puede provocar un adelgazamiento cortical y una reducción de las respuestas BOLD.
Se cree que la ínsula desempeña un papel en la integración de la información multimodal importante para las funciones sensitivomotoras, emocionales, alostáticas / homeostáticas y cognitivas (Devinsky y cols., 1995; Critchley, 2004; Craig, 2008) y ha sido designada corteza sensitiva límbica (Craig , 2008). Varios estudios han informado activación insular en respuesta a la estimulación táctil (Gelnar et al., 1998;
Downar et al., 2002) y estudios de rastreo anatómico en primates han demostrado que la ínsula está conectada recíprocamente a los lóbulos frontales, parietales y temporales (Agustín, 1996). En nuestros pacientes, la ínsula anterior derecha fue la única área cortical que demostró adelgazamiento cortical significativo junto con valores de anisotropía fraccional reducidos en la sustancia blanca adyacente, lo que sugiere que el adelgazamiento cortical dentro de esta región se asocia con una pérdida de fibras que se proyectan hacia o desde esta estructura La ínsula anterior derecha ha sido implicada en la interocepción ya que está situada para integrar la entrada homeostática del cuerpo con las condiciones motivacionales, emocionales y sociales (Craig, 2008). Además, Critchley et al. (2004) informó una correlación entre las capacidades interoceptivas y el volumen de materia gris de la ínsula anterior derecha. Dado nuestro hallazgo de que los pacientes tienen una disminución de la sustancia gris en la ínsula anterior derecha, sería interesante evaluar la capacidad interoceptiva después de la lesión del nervio periférico en un estudio futuro.
Tomados en conjunto, hemos demostrado por primera vez que las alteraciones funcionales y estructurales están presentes en la corteza cerebral humana 1.5 años después de una transección completa de un nervio periférico de miembro superior que se reparó microquirúrgicamente. Además, las medidas de conducción nerviosa indican una regeneración periférica incompleta en estos pacientes. Además, mostramos que el grosor cortical está relacionado con medidas psicofísicas de recuperación, en que la corteza más delgada dentro de BA2 y S2 se asoció con una función somatosensorial más pobre. Estos datos sugieren que el restablecimiento de mapas normales de activación funcional está directamente relacionado con la regeneración exitosa de aferentes periféricos.
Keri S. Taylor, 1,2 Dimitri J. Anastakis2,3,4 y Karen D. Davis1,2,3
1 División de Cerebro, Imágenes y Comportamiento Neurociencia de Sistemas, Toronto Western Research Institute, University Health Network, Toronto, Canadá M5T258
2 Instituto de Ciencias Médicas, Universidad de Toronto, Canadá
Departamento de Cirugía 3, Universidad de Toronto, Canadá
Centro de recursos de estudios clínicos 4, Instituto de investigación occidental de Toronto, Red de salud universitaria, Toronto, Canadá M5T2S8
Correspondencia a: Karen D. Davis, Ph.D.,
División de Cerebro, Imágenes y Comportamiento Neurociencia de Sistemas, Toronto Western Research Institute,
Toronto Western Hospital,
University Health Network,
Habitación MP14-306, 399 Bathurst Street,
Toronto, Ontario,
Canadá M5T 2S8
E-mail: kdavis@uhnres.utoronto.ca
Agradecimientos
Los autores agradecen al Sr. Geoff Pope, al Dr. Adrian Crawley, al Sr. Eugene Hlasny y al Sr. Keith Ta por la asistencia técnica experta. Los autores desean agradecer al Dr. Peter Ashby y al Sr. Freddy Paiz de la Clínica EMG Toronto Western Hospital por realizar las pruebas de conducción nerviosa y por proporcionar una evaluación experta de los hallazgos. Los autores también agradecen a los Drs Dvali, Binhammer, Fialkov y Antonyshyn por colaborar con este proyecto. El Dr. Davis es una Cátedra de Investigación de Canadá en Cerebro y Comportamiento (CIHR MOP 53304).
Oportunidades
Physicians Services Incorporated y una subvención inicial conjunta del Centro para el Estudio del Dolor de la Universidad de Toronto / AstraZeneca.
Material suplementario
El material complementario está disponible en Brain en línea.
en blanco
Referencias:
Apkarian AV, Sosa Y, Sonty S, et al. El dolor de espalda crónico está asociado con
disminución de la densidad de materia gris prefrontal y talámica. J Neurosci
2004; 24: 10410 5.
Arthurs OJ, Johansen-Berg H, Matthews PM, Boniface SJ. Atención
modula diferencialmente el acoplamiento de fMRI BOLD y evocado
amplitudes de señal potenciales en la corteza somatosensorial humana 7.
Exp Brain Res 2004; 157: 269 74.
Augustine JR. Circuitos y aspectos funcionales del lóbulo insular
en primates, incluidos los humanos. Brain Res Brain Res Rev 1996; 22:
229 44.
Beaulieu C.La base de la difusión de agua anisotrópica en el sistema nervioso
sistema - una revisión técnica. NMR Biomed 2002; 15: 435 55.
Bodegard A, Geyer S, Grefkes C, Zilles K, Roland PE. Jerárquico
procesamiento de la forma táctil en el cerebro humano. Neuron 2001; 31:
317 28.
Craig AD. Interocepción y emoción: una perspectiva neuroanatómica.
En: Lewis M, Haviland-Jones J, Barrett L, editores. Manual de
emociones. Nueva York: Guildford Press; 2008. p. 272 87.
Critchley HD. La corteza humana responde a un desafío interoceptivo.
Proc Natl Acad Sci USA 2004; 101: 6333 4.
Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ. Sistemas neuronales
apoyando la conciencia interoceptiva. Nat Neurosci 2004; 7: 189 95.
Dale AM, Fischl B, Sereno MI. Análisis basado en superficie cortical. I. Segmentación
y reconstrucción de superficies. Neuroimage 1999; 9: 179.
Davis KD, Pope G, Chen J, Kwan CL, Crawley AP, Diamant NE. Cortical
adelgazamiento en el SII: implicaciones para la homeostática, la atención y el dolor
Procesando. Neurology 2008; 70: 153 4.
DeLuca M, Beckmann CF, De SN, Matthews PM, Smith SM. fMRI en reposo
Las redes estatales definen distintos modos de interacciones a larga distancia.
en el cerebro humano. Neuroimage 2006; 29: 1359 67.
Devinsky O, Morrell MJ, Vogt BA. Contribuciones del cíngulo anterior
corteza al comportamiento. Brain 1995; 118 (Parte 1): 279-306.
Disbrow E, Roberts T, Poeppel D, Krubitzer L.Evidencia de interhemispheric
procesamiento de entradas de las manos en humanos S2
y PV. J Neurophysiol 2001; 85: 2236 44.
Downar J, Crawley AP, Mikulis DJ, Davis KD. Una red cortical sensible
para estimular la prominencia en un contexto de comportamiento neutral a través de múltiples
modalidades sensoriales. J Neurophysiology 2002; 87: 615-20.
Draganski B, Moser T, Lummel N y col. Disminución del gris tálamo
asunto tras la amputación de una extremidad. Neuroimage 2006; 31: 951 7.
Fischl B, Dale AM. Midiendo el grosor de la corteza cerebral humana
a partir de imágenes de resonancia magnética. Proc Natl Acad Sci USA 2000; 97:
11050 5.
Fischl B, Sereno MI, Dale AM. Análisis basado en la superficie cortical. II:
Inflado, aplanamiento y un sistema de coordenadas basado en superficie.
Neuroimage 1999a; 9: 195-207.
Fischl B, Sereno MI, Tootell RB, Dale AM. Intersujeto de alta resolución
promediado y un sistema de coordenadas para la superficie cortical. Hum cerebro
Mapp 1999b; 8: 272 84.
Florence SL, Kaas JH. Reorganización a gran escala en múltiples niveles del
La vía somatosensorial sigue a la amputación terapéutica de la mano.
en monos. J Neurosci 1995; 15: 8083 95.
Fox MD, Snyder AZ, Vincent JL, Corbetta M, Van E, Raichle ME. los
El cerebro humano está intrínsecamente organizado en dinámicos, anticorrelacionados
redes funcionales. Proc Natl Acad Sci USA 2005; 102: 9673 9678.
Friedman DP, Murray EA. Conectividad talámica del segundo
área somatosensorial y campos somatosensoriales vecinos del
surco lateral del macaco. J Comp Neurol 1986; 252: 348 73.
Frot M, Mauguiere F.Tiempo y distribución espacial de somatosensorial
respuestas registradas en el banco superior de la fisura de Silvio (área SII) en
humanos. Cereb Cortex 1999; 9: 854.
Geha PY, Baliki MN, Harden RN, Bauer WR, Parrish TB, Apkarian AV.
El cerebro en el dolor crónico por CRPS: sustancia gris-blanca anormal
interacciones en regiones emocionales y autónomas. Neuron 2008; 60:
570 81.
Gelnar PA, Krauss BR, Szeverenyi NM, Apkarian AV. Representación de la yema del dedo
en la corteza somatosensorial humana: un estudio de resonancia magnética funcional.
Neuroimage 1998; 7: 261 83.
Hickmott PW, Steen PA. Cambios a gran escala en la estructura dendrítica
durante la reorganización de la corteza somatosensorial adulta. Nat Neurosci
2005; 8: 140 42.
Iwamura Y, Tanaka M, Iriki A, Taoka M, Toda T.Procesamiento de
señales táctiles y cinestésicas de lados bilaterales del cuerpo en el
giro postcentral de los monos despiertos. Behav Brain Res 2002; 135:
185 90.
Jaquet JB, Luijsterburg AJ, Kalmijn S, Kuypers PD, Hofman A, Hovius SE.
Lesiones del nervio mediano, cubital y combinado del nervio mediano-cubital: funcional
resultado y retorno a la productividad. J Trauma 2001; 51: 687 92.
Jurkiewicz MT, Crawley AP, Verrier MC, Fehlings MG, Mikulis DJ.
Atrofia cortical somatosensorial después de una lesión de la médula espinal: un
estudio de morfometría. Neurology 2006; 66: 762 4.
Kaas JH. Plasticidad de mapas sensoriales y motores en mamíferos adultos. Annu
Rev Neurosci 1991; 14: 137 67.
Kaas JH, Jain N, Qi HX. La organización del sistema somatosensorial en
primates. En: Nelson RJ, editor. El sistema somatosensorial.
Washington, DC: CRC Press; 2002. p. 1 25.
Kimura J. Electrodiagnóstico en enfermedades del nervio y el músculo: principios
y practica. Oxford: Oxford University Press; 2001.
Kimura J. Principios y dificultades de los estudios de conducción nerviosa. Ann Neurol
1984; 16: 415 29.
Knyihar-Csillik E, Rakic P, Csillik B. Degeneración transneuronal en
la sustancia Rolando de la médula espinal de los primates evocada por
atrofia degenerativa transgangliónica inducida por axotomía de
terminales sensoriales primarios. Cell Tissue Res 1989; 258: 515-25.
Liss AG, af Ekenstam FW, Wiberg M. Pérdida de neuronas en la raíz dorsal
ganglios después de la sección transversal de un nervio sensorial periférico. Un anatómico
estudiar en monos. Scand J Plast Reconstr Surg Hand Surg 1996; 30: 1 6.
Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Movimientos fantasmas
y dolor. Un estudio de resonancia magnética funcional en amputados de miembros superiores. Brain 2001;
124: 2268 77.
Manduch M, Bezuhly M, Anastakis DJ, Crawley AP, Mikulis DJ. De serie
fMRI de cambios adaptativos en la corteza sensitivomotora primaria siguiendo
reconstrucción del pulgar. Neurology 2002; 59: 1278 81.
Mayo A. El dolor crónico puede cambiar la estructura del cerebro. Pain 2008;
137: 7 15.
McAllister RM, Gilbert SE, Calder JS, Smith PJ. La epidemiología y
tratamiento de las lesiones de los nervios periféricos de las extremidades superiores en
práctica. J Hand Surg (Br) 1996; 21: 4 13.
Murray EA, Mishkin M. Contribuciones relativas de SII y area5 al tacto
discriminación en monos 2. Behav Brain Res 1984; 11: 67 83.
Napadow V, Kettner N, Ryan A, Kwong KK, Audette J, Hui KK.
Plasticidad cortical somatosensorial en el síndrome del túnel carpiano: una sección transversal
Evaluación por resonancia magnética funcional. Neuroimage 2006; 31: 520-30.
Oldfield RC. La evaluación y el análisis de la mano: el Edimburgo
inventario. Neuropsychologia 1971; 9: 97-113.
Pons TP, Garraghty PE, Cusick CG, Kaas JH. La organización somatotópica
del área 2 en monos macacos 6. J Comp Neurol 1985; 241: 445 66.
Pons TP, Garraghty PE, Friedman DP, Mishkin M. Evidencia fisiológica
para el procesamiento en serie en la corteza somatosensorial. Science 1987; 237:
417 20.
Porro CA, Lui F, Facchin P, Maieron M, Baraldi P. Actividad relacionada con la percepción
en el sistema somatosensorial humano: resonancia magnética funcional
estudios de imagen. Magn Reson Imaging 2004; 22: 1539 48.
Powell TP, Erulkar S. Degeneración celular transneuronal en el auditivo
relé núcleos del gato. J Anat 1962; 96: 249.
Ridley RM, Ettlinger G. Aprendizaje y retención táctiles deteriorados después
extracciones de la segunda corteza de proyección sensorial somática (SII) en el
mono. Brain Res 1976; 109: 656 60.
Rosen B, Lundborg G. Un nuevo instrumento de gnosis táctil en la sensibilidad
pruebas. J Hand Ther 1998; 11: 251 7.
Seminowicz DA, Davis KD. El dolor mejora la conectividad funcional
de una red cerebral evocada por la realización de una tarea cognitiva.
J Neurophysiol 2007; 97: 3651 9.
Smith SM, Jenkinson M, Johansen-Berg H, et al. Espacial basado en áreas
Estadísticas: análisis por vóxeles de datos de difusión de múltiples sujetos.
Neuroimage 2006; 31: 1487 1505.
Talairach J, Tournoux P. Atlas estereotáxico coplanar del cerebro humano.
Nueva York: Thieme Medical Publishers Inc .; 1988.
Taylor KS, Anastakis DJ, Davis KD. Dolor crónico después de periférico
la lesión nerviosa se asocia con dolor catastrófico y neuroticismo.
Int Ass Stud Pain 2008a; 267.
Taylor KS, Davis KD. Estabilidad de la resonancia magnética funcional táctil y relacionada con el dolor
activaciones cerebrales: un examen de umbral dependiente y
métodos independientes del umbral. Hum Brain Mapp 2009; 30:
1947 62.
Taylor KS, Seminowicz DA, Davis KD. Dos sistemas de estado de reposo
conectividad entre la ínsula y la corteza cingulada. Hum cerebro
Mapp 2008b; DOI: 10.1002 / hbm.20705.
Wall JT, Kaas JH, Sur M, Nelson RJ, Felleman DJ, Merzenich MM.
Reorganización funcional en áreas corticales somatosensoriales 3b y 1
de monos adultos después de la reparación del nervio mediano: posible relación con
recuperación sensorial en humanos. J Neurosci 1986; 6: 218 33.
Acordeón cercano
Alcance de la práctica profesional *
La información aquí contenida en "Cortar su nervio cambia su cerebro | El Paso, TX." no pretende reemplazar una relación personal con un profesional de la salud calificado o un médico con licencia y no es un consejo médico. Lo alentamos a que tome decisiones de atención médica basadas en su investigación y asociación con un profesional de la salud calificado.
Información del blog y debates sobre el alcance
Nuestro alcance informativo se limita a la quiropráctica, musculoesquelética, medicina física, bienestar, contribuyendo etiológico alteraciones viscerosomáticas dentro de las presentaciones clínicas, la dinámica clínica del reflejo somatovisceral asociado, los complejos de subluxación, los problemas de salud delicados y/o los artículos, temas y debates de medicina funcional.
Brindamos y presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista se rige por su ámbito de práctica profesional y su jurisdicción de licencia. Utilizamos protocolos funcionales de salud y bienestar para tratar y apoyar la atención de lesiones o trastornos del sistema musculoesquelético.
Nuestros videos, publicaciones, temas, asuntos e ideas cubren cuestiones clínicas, problemas y temas que se relacionan y respaldan directa o indirectamente nuestro ámbito de práctica clínica.*
Nuestra oficina ha intentado razonablemente proporcionar citas de apoyo y ha identificado el estudio o los estudios de investigación relevantes que respaldan nuestras publicaciones. Proporcionamos copias de los estudios de investigación de respaldo disponibles para las juntas reguladoras y el público a pedido.
Entendemos que cubrimos asuntos que requieren una explicación adicional de cómo puede ayudar en un plan de atención o protocolo de tratamiento en particular; por lo tanto, para discutir más a fondo el tema anterior, no dude en preguntar Dr. Alex Jiménez, DC, o póngase en contacto con nosotros en 915-850-0900.
Estamos aquí para ayudarlo a usted y a su familia.
Bendiciones
El Dr. Alex Jimenez corriente continua MSACP, enfermero*, CCCT, IFMCP*, CIFM*, ATN*
email: coach@elpasomedicinafuncional.com
Licenciado como Doctor en Quiropráctica (DC) en Texas & New Mexico*
Número de licencia de Texas DC TX5807, Nuevo México DC Número de licencia NM-DC2182
Licenciada como enfermera registrada (RN*) in Florida
Licencia de Florida Licencia de RN # RN9617241 (Control No. 3558029)
Estado compacto: Licencia multiestatal: Autorizado para ejercer en 40 Estados*
Dr. Alex Jiménez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mi tarjeta de presentación digital