El dolor es la respuesta natural del cuerpo humano a una lesión o enfermedad, y a menudo es una advertencia de que algo anda mal. Una vez que el problema se cura, generalmente dejamos de experimentar este síntoma doloroso, sin embargo, ¿qué sucede cuando el dolor continúa mucho después de que la causa desaparezca? Dolor crónico se define médicamente como dolor persistente que dura de 3 a 6 meses o más. El dolor crónico es sin duda una condición desafiante para vivir, que afecta todo, desde los niveles de actividad del individuo y su capacidad para trabajar, así como sus relaciones personales y condiciones psicológicas. Pero, ¿sabe que el dolor crónico también puede estar afectando la estructura y la función de su cerebro? Resulta que estos cambios cerebrales pueden llevar a un deterioro cognitivo y psicológico.
El dolor crónico no solo influye en una región singular de la mente; de hecho, puede dar lugar a cambios en numerosas áreas esenciales del cerebro, la mayoría de las cuales están involucradas en muchos procesos y funciones fundamentales. Varios estudios de investigación a lo largo de los años han encontrado alteraciones en el hipocampo, junto con la reducción de la materia gris de la corteza prefrontal dorsolateral, la amígdala, el tallo cerebral y la corteza insular derecha, por nombrar algunos, asociados con el dolor crónico. Un desglose de algunas de las estructuras de estas regiones y sus funciones relacionadas podría ayudar a poner estos cambios cerebrales en contexto, para muchas personas con dolor crónico. El propósito del siguiente artículo es demostrar y discutir los cambios cerebrales funcionales y estructurales asociados con el dolor crónico, particularmente en el caso en que estos probablemente no reflejen daño ni atrofia.
Contenido
Los cambios cerebrales estructurales en el dolor crónico no reflejan probablemente daño ni atrofia
Resumen
El dolor crónico parece estar asociado con la reducción de la materia gris del cerebro en áreas atribuibles a la transmisión del dolor. Los procesos morfológicos que subyacen a estos cambios estructurales, probablemente después de la reorganización funcional y la plasticidad central en el cerebro, siguen sin estar claros. El dolor en la osteoartritis de cadera es uno de los pocos síndromes de dolor crónico que son principalmente curables. Investigamos a 20 pacientes con dolor crónico debido a coxartrosis unilateral (edad media 63.25 a 9.46 (DE) años, 10 mujeres) antes de la cirugía endoprótesis de la articulación de la cadera (estado de dolor) y monitorizamos los cambios estructurales cerebrales hasta 1 año después de la cirugía: 6-8 semanas , 12-18 semanas y 10-14 meses cuando esté completamente libre de dolor. Los pacientes con dolor crónico debido a coxartrosis unilateral tenían significativamente menos materia gris en comparación con los controles en la corteza cingulada anterior (ACC), la corteza insular y el opérculo, la corteza prefrontal dorsolateral (DLPFC) y la corteza orbitofrontal. Estas regiones funcionan como estructuras multi-integradoras durante la experiencia y la anticipación del dolor. Cuando los pacientes estaban libres de dolor después de la recuperación de la cirugía endoprótesis, se encontró un aumento de materia gris en casi las mismas áreas. También encontramos un aumento progresivo de la materia gris del cerebro en la corteza premotora y el área motora suplementaria (SMA). Concluimos que las anomalías de la materia gris en el dolor crónico no son la causa, sino secundarias a la enfermedad y, al menos en parte, se deben a cambios en la función motora y la integración corporal.
Introducción
La evidencia de reorganización funcional y estructural en pacientes con dolor crónico respalda la idea de que el dolor crónico no solo debe conceptualizarse como un estado funcional alterado, sino también como una consecuencia de la plasticidad cerebral funcional y estructural [1], [2], [3], [4], [5], [6]. En los últimos seis años, se publicaron más de 20 estudios que demuestran cambios cerebrales estructurales en 14 síndromes de dolor crónico. Una característica sorprendente de todos estos estudios es el hecho de que los cambios en la materia gris no se distribuyeron al azar, sino que ocurren en áreas cerebrales definidas y funcionalmente altamente específicas, es decir, la participación en el procesamiento nociceptivo supraespinal. Los hallazgos más destacados fueron diferentes para cada síndrome de dolor, pero se superpusieron en la corteza cingulada, la corteza orbitofrontal, la ínsula y la protuberancia dorsal [4]. Otras estructuras comprenden el tálamo, la corteza prefrontal dorsolateral, los ganglios basales y el área del hipocampo. Estos hallazgos a menudo se discuten como atrofia celular, lo que refuerza la idea de daño o pérdida de materia gris cerebral [7], [8], [9]. De hecho, los investigadores encontraron una correlación entre la disminución de la materia gris del cerebro y la duración del dolor [6]. Pero la duración del dolor también está relacionada con la edad del paciente, y la disminución global, pero también regionalmente específica, de la materia gris, dependiente de la edad, está bien documentada [10]. Por otro lado, estos cambios estructurales también podrían ser una disminución del tamaño celular, fluidos extracelulares, sinaptogénesis, angiogénesis o incluso debido a cambios en el volumen sanguíneo [11], [4], [12]. Cualquiera que sea la fuente, para nuestra interpretación de tales hallazgos es importante ver estos hallazgos morfométricos a la luz de una gran cantidad de estudios morfométricos en la plasticidad dependiente del ejercicio, dado que se han demostrado repetidamente cambios estructurales del cerebro regionalmente específicos después del ejercicio cognitivo y físico [ 13].
No se entiende por qué solo una proporción relativamente pequeña de humanos desarrolla un síndrome de dolor crónico, considerando que el dolor es una experiencia universal. Surge la pregunta de si en algunos seres humanos una diferencia estructural en los sistemas centrales de transmisión del dolor puede actuar como una diátesis para el dolor crónico. Los cambios de materia gris en el dolor fantasma debido a la amputación [15] y la lesión de la médula espinal [3] indican que los cambios morfológicos del cerebro son, al menos en parte, una consecuencia del dolor crónico. Sin embargo, el dolor en la osteoartritis de cadera (OA) es uno de los pocos síndrome de dolor crónico que es principalmente curable, ya que el 88% de estos pacientes no sienten dolor después de la cirugía de reemplazo total de cadera (THR) [16]. En un estudio piloto hemos analizado diez pacientes con OA de cadera antes y poco después de la cirugía. Encontramos disminuciones de materia gris en la corteza cingulada anterior (ACC) y la ínsula durante el dolor crónico antes de la cirugía de THR y encontramos aumentos de materia gris en las áreas cerebrales correspondientes en la condición libre de dolor después de la cirugía [17]. Centrándonos en este resultado, ahora expandimos nuestros estudios investigando más pacientes (n? =? 20) después de una THR exitosa y monitoreamos los cambios estructurales del cerebro en cuatro intervalos de tiempo, hasta un año después de la cirugía. Para controlar los cambios en la materia gris debido a la mejora motora o la depresión, también administramos cuestionarios dirigidos a la mejora de la función motora y la salud mental.
Materiales y Métodos
Voluntariado
Los pacientes informados aquí son un subgrupo de 20 pacientes de 32 pacientes publicados recientemente que se compararon con un grupo de control sano de la misma edad y sexo [17], pero participaron en una investigación adicional de seguimiento de un año. Después de la cirugía, 12 pacientes abandonaron debido a una segunda cirugía endoprótesis (n? =? 2), enfermedad grave (n? =? 2) y retirada del consentimiento (n? =? 8). Esto dejó a un grupo de veinte pacientes con OA de cadera primaria unilateral (edad media 63.25-9.46 (DE) años, 10 mujeres) que fueron investigados cuatro veces: antes de la cirugía (estado de dolor) y nuevamente 6 y 8-12 semanas y 18 10 meses después de la cirugía endoprotésica, cuando esté completamente libre de dolor. Todos los pacientes con OA de cadera primaria tenían un historial de dolor de más de 14 meses, con un rango de 12 a 1 años (promedio de 33 años) y una puntuación de dolor promedio de 7.35 (rango de 65.5 a 40) en una escala analógica visual (EVA) que varía de 90 (sin dolor) a 0 (el peor dolor imaginable). Evaluamos cualquier aparición de episodios de dolor menor, incluidos dolor de muelas, oídos y cefalea hasta 100 semanas antes del estudio. También seleccionamos aleatoriamente los datos de 4 controles sanos emparejados por sexo y edad (edad media 20 60,95 (DE) años, 8,52 mujeres) de los 10 del estudio piloto mencionado anteriormente [32]. Ninguno de los 17 pacientes o de los 20 voluntarios sanos emparejados por sexo y edad tenía antecedentes médicos internos o neurológicos. El estudio recibió la aprobación ética del comité de ética local y se obtuvo el consentimiento informado por escrito de todos los participantes del estudio antes del examen.
Datos de comportamiento
Recopilamos datos sobre depresión, somatización, ansiedad, dolor y salud física y mental en todos los pacientes y en los cuatro puntos temporales utilizando los siguientes cuestionarios estandarizados: Inventario de depresión de Beck (BDI) [18], Inventario breve de síntomas (BSI) [19], Schmerzempfindungs-Skala (SES? =? Escala de dolor desagradable) [20] y Formulario breve de 36 elementos de la encuesta de salud (SF-36) [21] y el Perfil de salud de Nottingham (NHP). Realizamos ANOVA de medidas repetidas y pruebas t de dos colas emparejadas para analizar los datos de comportamiento longitudinal usando SPSS 13.0 para Windows (SPSS Inc., Chicago, IL), y usamos la corrección de Greenhouse Geisser si se violó el supuesto de esfericidad. El nivel de significancia se fijó en p <0.05.
VBM - Adquisición de datos
Adquisición de imágen. La exploración por RM de alta resolución se realizó en un sistema de RM 3T (Siemens Trio) con una bobina de cabeza estándar de 12 canales. Para cada uno de los cuatro puntos de tiempo, escaneo I (entre 1 día y 3 meses antes de la cirugía endoprotésica), escaneo II (6 a 8 semanas después de la cirugía), escaneo III (12 a 18 semanas después de la cirugía) y escaneo IV (10-14 meses después de la cirugía), se adquirió una resonancia magnética estructural ponderada en T1 para cada paciente utilizando una secuencia 3D-FLASH (TR 15 ms, TE 4.9 ms, ángulo de giro 25 °, cortes de 1 mm, FOV 256-256, tamaño de vóxel 1. 1 mm).
Procesamiento de imágenes y análisis estadístico
El preprocesamiento y el análisis de los datos se realizaron con SPM2 (Wellcome Department of Cognitive Neurology, Londres, Reino Unido) bajo Matlab (Mathworks, Sherborn, MA, EE. UU.) Y que contiene una caja de herramientas de morfometría basada en vóxel (VBM) para datos longitudinales, que se basa en imágenes de resonancia magnética estructural en 3D de alta resolución y permite aplicar estadísticas vóxel-sabias para detectar diferencias regionales en la densidad o volúmenes de la materia gris [22], [23]. En resumen, el preprocesamiento implicaba normalización espacial, segmentación de materia gris y suavizado espacial de 10 mm con un núcleo gaussiano. Para los pasos de preprocesamiento, utilizamos un protocolo optimizado [22], [23] y una plantilla de materia gris específica para escáner y estudio [17]. Utilizamos SPM2 en lugar de SPM5 o SPM8 para hacer este análisis comparable a nuestro estudio piloto [17]. ya que permite una excelente normalización y segmentación de datos longitudinales. Sin embargo, a medida que una actualización más reciente de VBM (VBM8) estuvo disponible recientemente (dbm.neuro.uni-jena.de/vbm/), también usamos VBM8.
Análisis de sección transversal
Usamos una prueba t de dos muestras con el fin de detectar diferencias regionales en la materia gris del cerebro entre los grupos (pacientes en el punto de tiempo de exploración I (dolor crónico) y controles sanos). Aplicamos un umbral de p <0.001 (sin corregir) en todo el cerebro debido a nuestra fuerte hipótesis a priori, que se basa en 9 estudios independientes y cohortes que muestran disminuciones en la materia gris en pacientes con dolor crónico [7], [8], [ 9], [15], [24], [25], [26], [27], [28], que los aumentos de materia gris aparecerán en las mismas regiones (relevantes para el procesamiento del dolor) que en nuestro estudio piloto (17 ). Los grupos se emparejaron por edad y sexo sin diferencias significativas entre los grupos. Para investigar si las diferencias entre los grupos cambiaron después de un año, también comparamos a los pacientes en el momento de la exploración IV (sin dolor, un año de seguimiento) con nuestro grupo de control sano.
Análisis Longitudinal
Para detectar diferencias entre puntos de tiempo (Scan I IV) comparamos las exploraciones antes de la cirugía (estado de dolor) y nuevamente 6 8 y 12 18 semanas y 10 14 meses después de la cirugía endoprotésica (sin dolor) como ANOVA de medida repetida. Debido a que cualquier cambio cerebral debido al dolor crónico puede necesitar algún tiempo para desaparecer después de la operación y el cese del dolor y debido al dolor posoperatorio que informaron los pacientes, comparamos en el análisis longitudinal la exploración I y II con la exploración III y IV. Para detectar cambios que no están estrechamente relacionados con el dolor, también buscamos cambios progresivos en todos los intervalos de tiempo. Volteamos los cerebros de los pacientes con OA de la cadera izquierda (n? =? 7) para normalizar el lado del dolor tanto para la comparación de grupos como para el análisis longitudinal, pero principalmente analizamos los datos sin voltear. Usamos la puntuación BDI como covariable en el modelo.
Resultados
Datos de comportamiento
Todos los pacientes informaron dolor crónico de cadera antes de la cirugía y estaban libres de dolor (con respecto a este dolor crónico) inmediatamente después de la cirugía, pero informaron dolor posoperatorio bastante agudo en la exploración II que era diferente del dolor debido a la osteoartritis. El puntaje de salud mental del SF-36 (F (1.925 / 17.322)? =? 0.352, p? =? 0.7) y el puntaje global de BSI GSI (F (1.706 / 27.302)? =? 3.189, p? =? 0.064 ) no mostraron cambios en el transcurso del tiempo ni comorbilidad mental. Ninguno de los controles informó dolor agudo o crónico y ninguno mostró síntomas de depresión o discapacidad física / mental.
Antes de la cirugía, algunos pacientes mostraron síntomas depresivos leves a moderados en las puntuaciones BDI que disminuyeron significativamente en la exploración III (t (17)? =? 2.317, p? =? 0.033) y IV (t (16)? =? 2.132, p? =? 0.049). Además, las puntuaciones de SES (dolor desagradable) de todos los pacientes mejoraron significativamente desde la exploración I (antes de la cirugía) a la exploración II (t (16)? =? 4.676, p <0.001), exploración III (t (14)? =? 4.760, p <0.001) y exploración IV (t (14)? =? 4.981, p <0.001, 1 año después de la cirugía) ya que el malestar del dolor disminuyó con la intensidad del dolor. La calificación de dolor en la exploración 1 y 2 fue positiva, la misma calificación en el día 3 y 4 negativa. El SES solo describe la calidad del dolor percibido. Por lo tanto, fue positivo el día 1 y 2 (media 19.6 el día 1 y 13.5 el día 2) y negativo (na) el día 3 y 4. Sin embargo, algunos pacientes no entendieron este procedimiento y utilizaron el SES como una calidad global. de la vida medida. Es por eso que a todos los pacientes se les preguntó el mismo día individualmente y por la misma persona sobre la aparición del dolor.
En la encuesta de salud de formato corto (SF-36), que consiste en las medidas de resumen de una puntuación de salud física y una puntuación de salud mental [29], los pacientes mejoraron significativamente en la puntuación de salud física desde la exploración I a la exploración II (t ( 17)? = ?? 4.266, p? =? 0.001), escaneo III (t (16)? = ?? 8.584, p <0.001) y IV (t (12)? = ?? 7.148, p <0.001), pero no en el puntaje de salud mental. Los resultados del NHP fueron similares, en la subescala `` dolor '' (polaridad inversa) observamos un cambio significativo de la exploración I a la exploración II (t (14)? = ?? 5.674, p <0.001, exploración III (t (12) )? = ?? 7.040, p <0.001 y escaneo IV (t (10)? = ?? 3.258, p? =? 0.009). También encontramos un aumento significativo en la subescala movilidad física desde el escaneo I al escaneo III (t (12)? = ?? 3.974, p? =? 0.002) y escaneo IV (t (10)? = ?? 2.511, p? =? 0.031). No hubo cambios significativos entre el escaneo I y el escaneo II ( seis semanas después de la cirugía).
Datos Estructurales
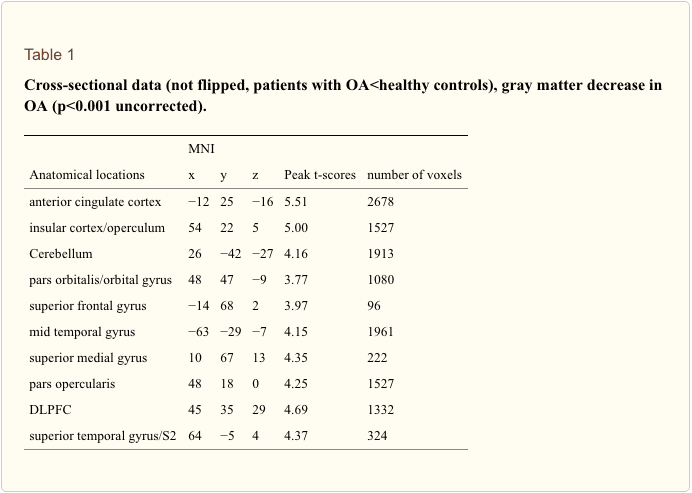
Análisis transversal. Incluimos la edad como una covariable en el modelo lineal general y no encontramos factores de confusión de edad. En comparación con los controles emparejados por sexo y edad, los pacientes con OA de cadera primaria (n? =? 20) mostraron una reducción preoperatoria (Scan I) de materia gris en la corteza cingulada anterior (ACC), la corteza insular, el opérculo, la corteza prefrontal dorsolateral DLPFC), polo temporal derecho y cerebelo (Tabla 1 y Figura 1). Excepto por el putamen derecho (x? =? 31, y? = ?? 14, z? = ?? 1; p <0.001, t? =? 3.32) no se encontró un aumento significativo en la densidad de materia gris en pacientes con OA en comparación con a controles saludables. Al comparar a los pacientes en el punto de tiempo de la exploración IV con los controles emparejados, se encontraron los mismos resultados que en el análisis transversal utilizando la exploración I en comparación con los controles.
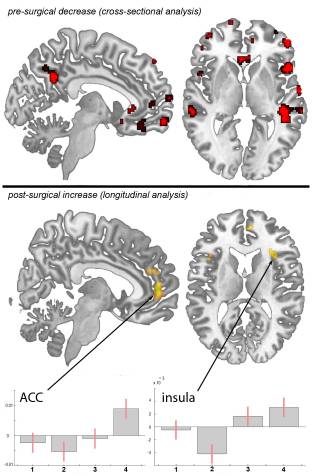
Figura 1: mapas paramétricos estadísticos que demuestran las diferencias estructurales en materia gris en pacientes con dolor crónico debido a OA de cadera primaria en comparación con los controles y longitudinalmente en comparación con ellos a lo largo del tiempo. Los cambios significativos de materia gris se muestran superpuestos en color, los datos transversales se representan en rojo y los datos longitudinales en amarillo. Plano axial: el lado izquierdo de la imagen es el lado izquierdo del cerebro. arriba: áreas de disminución significativa de materia gris entre pacientes con dolor crónico debido a OA de cadera primaria y sujetos de control no afectados. p <0.001 parte inferior sin corregir: aumento de la materia gris en 20 pacientes sin dolor en el tercer y cuarto período de exploración después de la cirugía de reemplazo total de cadera, en comparación con la primera exploración (preoperatoria) y la segunda exploración (6-8 semanas después de la cirugía). p <0.001 Gráficos no corregidos: Estimaciones de contraste e intervalo de confianza del 90%, efectos de interés, unidades arbitrarias. eje x: contrastes para los 4 puntos de tiempo, eje y: estimación de contraste en? 3, 50, 2 para ACC y estimación de contraste en 36, 39, 3 para ínsula.
Dar la vuelta a los datos de los pacientes con OA de cadera izquierda (n? =? 7) y compararlos con controles sanos no cambió los resultados significativamente, pero para una disminución en el tálamo (x? =? 10, y? = ?? 20, z? =? 3, p <0.001, t? =? 3.44) y un aumento en el cerebelo derecho (x? =? 25, y? = ?? 37, z? = ?? 50, p <0.001, t? =? 5.12) que no alcanzó significación en los datos sin voltear de los pacientes en comparación con los controles.
Análisis longitudinal En el análisis longitudinal, se detectó un aumento significativo (p <001 sin corregir) de materia gris al comparar el primer y segundo escaneo (dolor crónico / dolor posquirúrgico) con el tercer y cuarto escaneo (sin dolor) en el ACC, corteza insular, cerebelo y pars orbitalis en los pacientes con OA (Tabla 2 y Figura 1). La materia gris disminuyó con el tiempo (p <001 en el análisis de todo el cerebro sin corregir) en la corteza somatosensorial secundaria, el hipocampo, la corteza midcingulada, el tálamo y el núcleo caudado en pacientes con OA (Figura 2).
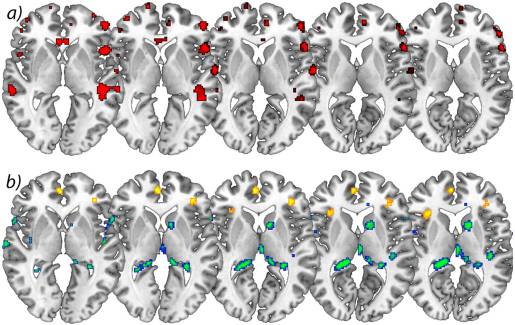
Figura 2: a) Aumentos significativos de la materia gris del cerebro después de una operación exitosa. Vista axial de la disminución significativa de la materia gris en pacientes con dolor crónico debido a OA de cadera primaria en comparación con sujetos de control. p <0.001 sin corregir (análisis transversal), b) Aumento longitudinal de la materia gris a lo largo del tiempo en amarillo comparando exploración I y II exploración III> exploración IV) en pacientes con OA. p <0.001 sin corregir (análisis longitudinal). El lado izquierdo de la imagen es el lado izquierdo del cerebro.
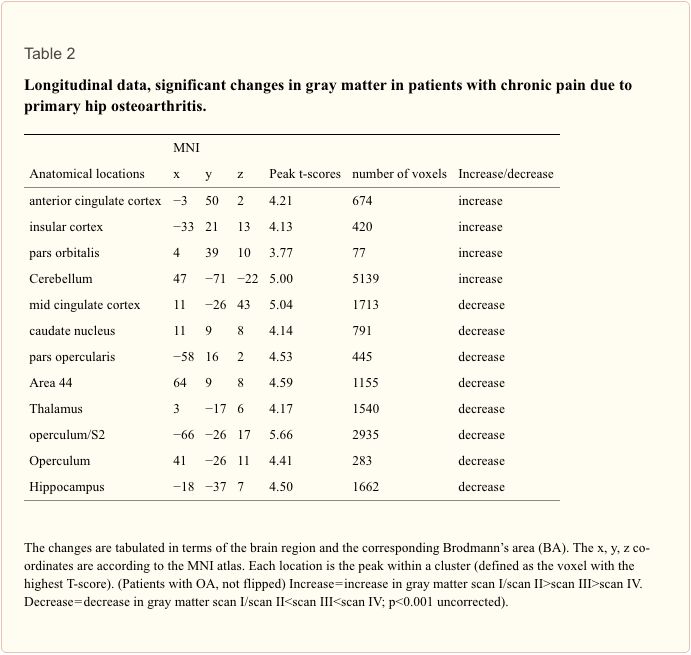
Cambiar los datos de los pacientes con OA de cadera izquierda (n? =? 7) no cambió los resultados de forma significativa, pero sí una disminución de la materia gris del cerebro en la circunvolución de Heschl (x? = ?? 41, y? = ?? 21, z? =? 10, p <0.001, t? =? 3.69) y Precuneus (x? =? 15, y? = ?? 36, z? =? 3, p <0.001, t? =? 4.60) .
Al contrastar la primera exploración (precirugía) con las exploraciones 3 + 4 (poscirugía), encontramos un aumento de materia gris en la corteza frontal y la corteza motora (p <0.001 sin corregir). Observamos que este contraste es menos estricto ya que ahora tenemos menos exploraciones por condición (dolor frente a no dolor). Cuando bajamos el umbral repetimos lo que hemos encontrado usando el contraste de 1 + 2 vs.3 + 4.
Al buscar áreas que aumentan en todos los intervalos de tiempo, encontramos cambios en la materia gris del cerebro en las áreas motoras (área 6) en pacientes con coxartrosis después de un reemplazo total de cadera (exploración Idbm.neuro.uni-jena.de/vbm/) podríamos replicar este hallazgo en la corteza cingulada anterior y media y en ambas ínsulas anteriores.
Calculamos los tamaños del efecto y el análisis transversal (pacientes versus controles) arrojó un Cohen? Sd de 1.78751 en el vóxel pico del ACC (x? = ?? 12, y? =? 25, z? = ?? dieciséis). También calculamos Cohen sd para el análisis longitudinal (barrido de contraste 16 + 1 vs barrido 2 + 3). Esto resultó en un Cohen sd de 4 en el ACC (x? = ?? 1.1158, y? =? 3, z? =? 50). Con respecto a la ínsula (x? = ?? 2, y? =? 33, z? =? 21) y relacionada con el mismo contraste, Cohen sd es 13. Además, calculamos la media de los valores de vóxel distintos de cero del mapa de Cohen? Sd dentro del ROI (compuesto por la división anterior de la circunvolución cingulada y la corteza subcallosa, derivada del Atlas estructural cortical de Harvard-Oxford): 1.0949.

Información del Dr. Alex Jiménez
Los pacientes con dolor crónico pueden experimentar una variedad de problemas de salud a lo largo del tiempo, además de sus síntomas ya debilitantes. Por ejemplo, muchas personas experimentarán problemas para dormir como resultado de su dolor, pero lo más importante es que el dolor crónico puede causar diversos problemas de salud mental, como ansiedad y depresión. Los efectos que el dolor puede tener en el cerebro pueden parecer demasiado abrumadores, pero la creciente evidencia sugiere que estos cambios cerebrales no son permanentes y pueden revertirse cuando los pacientes con dolor crónico reciben el tratamiento adecuado para sus problemas de salud subyacentes. Según el artículo, las anormalidades de la sustancia gris que se encuentran en el dolor crónico no reflejan el daño cerebral, sino que son una consecuencia reversible que se normaliza cuando el dolor se trata adecuadamente. Afortunadamente, hay una variedad de enfoques de tratamiento disponibles para ayudar a aliviar los síntomas del dolor crónico y restaurar la estructura y función del cerebro.
Discusión
Al monitorear la estructura completa del cerebro a lo largo del tiempo, confirmamos y ampliamos nuestros datos piloto publicados recientemente [17]. Encontramos cambios en la materia gris del cerebro en pacientes con osteoartritis primaria de cadera en estado de dolor crónico, que se revierten en parte cuando estos pacientes no sienten dolor, luego de una cirugía endoprotésica de la articulación de la cadera. El aumento parcial de la materia gris después de la cirugía ocurre casi en las mismas áreas donde se ha observado una disminución de la materia gris antes de la cirugía. Cambiar los datos de los pacientes con OA de cadera izquierda (y por lo tanto normalizar el lado del dolor) tuvo solo un impacto pequeño en los resultados, pero además mostró una disminución de la materia gris en la circunvolución de Heschl y Precuneus que no podemos explicar fácilmente y, como no existe una hipótesis a priori, considérelo con mucha cautela. Sin embargo, la diferencia observada entre los pacientes y los controles sanos en la exploración I todavía era observable en el análisis transversal en la exploración IV. El aumento relativo de materia gris a lo largo del tiempo es, por lo tanto, sutil, es decir, no lo suficientemente distinto para tener un efecto en el análisis transversal, un hallazgo que ya se ha demostrado en estudios que investigan la plasticidad dependiente de la experiencia [30], [31]. Observamos que el hecho de que demostremos que algunas partes de los cambios cerebrales debidos al dolor crónico son reversibles no excluye que otras partes de estos cambios sean irreversibles.
Curiosamente, observamos que la materia gris disminuye en el ACC en pacientes con dolor crónico antes de que la cirugía continúe 6 semanas después de la cirugía (exploración II) y solo aumenta hacia exploración III y IV, posiblemente debido a dolor posquirúrgico o disminución en el motor función. Esto está en línea con los datos de comportamiento del puntaje de movilidad física incluido en el NHP, que después de la cirugía no mostró ningún cambio significativo en el punto de tiempo II pero aumentó significativamente hacia el escaneo III y IV. Es de destacar que nuestros pacientes no informaron dolor en la cadera después de la cirugía, pero experimentaron dolor postoperatorio en los músculos circundantes y en la piel, que los pacientes percibieron de forma muy diferente. Sin embargo, como los pacientes todavía informaron algo de dolor en el examen II, también contrastamos el primer examen (previo a la cirugía) con escáneres III + IV (postoperatorio), revelando un aumento de la materia gris en la corteza frontal y la corteza motora. Observamos que este contraste es menos estricto debido a menos escaneos por condición (dolor vs. no dolor). Cuando bajamos el umbral, repetimos lo que hemos encontrado utilizando el contraste de I + II vs. III + IV.
Nuestros datos sugieren fuertemente que las alteraciones de la materia gris en pacientes con dolor crónico, que generalmente se encuentran en áreas involucradas en el procesamiento nociceptivo supraespinal [4], no se deben a atrofia neuronal ni daño cerebral. El hecho de que estos cambios observados en el estado de dolor crónico no se reviertan por completo podría explicarse con el período relativamente corto de observación (un año después de la operación versus una media de siete años de dolor crónico antes de la operación). Los cambios neuroplásticos del cerebro que pueden haberse desarrollado durante varios años (como consecuencia de una entrada nociceptiva constante) probablemente necesiten más tiempo para revertirse por completo. Otra posibilidad por la que el aumento de materia gris solo puede detectarse en los datos longitudinales pero no en los datos transversales (es decir, entre cohortes en el punto de tiempo IV) es que el número de pacientes (n? =? 20) es demasiado pequeño. Es necesario señalar que la varianza entre los cerebros de varios individuos es bastante grande y que los datos longitudinales tienen la ventaja de que la varianza es relativamente pequeña ya que los mismos cerebros se escanean varias veces. En consecuencia, los cambios sutiles solo serán detectables en los datos longitudinales [30], [31], [32]. Por supuesto, no podemos excluir que estos cambios sean al menos parcialmente irreversibles, aunque eso es poco probable, dados los hallazgos del ejercicio de plasticidad y reorganización estructural específicas [4], [12], [30], [33], [34]. Para responder a esta pregunta, los estudios futuros deben investigar a los pacientes repetidamente durante períodos de tiempo más largos, posiblemente años.
Observamos que solo podemos sacar conclusiones limitadas con respecto a la dinámica de los cambios cerebrales morfológicos a lo largo del tiempo. El motivo es que cuando diseñamos este estudio en 2007 y escaneamos en 2008 y 2009, no se sabía si ocurrirían cambios estructurales y, por razones de viabilidad, elegimos las fechas de escaneo y los plazos, tal como se describe aquí. Se podría argumentar que la materia gris cambia en el tiempo, lo que describimos para el grupo de pacientes, también podría haber sucedido en el grupo de control (efecto de tiempo). Sin embargo, se esperaría que cualquier cambio debido al envejecimiento, en todo caso, sea una disminución en el volumen. Dada nuestra hipótesis a priori, basada en estudios independientes 9 y cohortes que muestran disminuciones en la materia gris en pacientes con dolor crónico [7], [8], [9], [15], [24], [25], [26], [27], [28], nos centramos en los aumentos regionales a lo largo del tiempo y, por lo tanto, creemos que nuestro hallazgo no es un simple efecto de tiempo. Cabe destacar que no podemos descartar que la materia gris disminuya con el tiempo que encontramos en nuestro grupo de pacientes podría deberse a un efecto de tiempo, ya que no hemos escaneado nuestro grupo de control en el mismo período de tiempo. Dados los hallazgos, los estudios futuros deberían apuntar a intervalos de tiempo más cortos, dado que los cambios cerebrales morfométricos dependientes del ejercicio pueden ocurrir tan rápido como después de la semana 1 [32], [33].
Además del impacto del aspecto nociceptivo del dolor en la sustancia gris del cerebro [17], [34] observamos que los cambios en la función motora probablemente también contribuyen a los cambios estructurales. Encontramos áreas motoras y premotoras (área 6) que aumentan en todos los intervalos de tiempo (Figura 3). Intuitivamente, esto puede deberse a la mejora de la función motora a lo largo del tiempo, ya que los pacientes no estaban más restringidos en la vida normal. Notablemente, no nos enfocamos en la función motora, sino en una mejora en la experiencia del dolor, dada nuestra búsqueda original para investigar si la reducción bien conocida en la materia gris del cerebro en pacientes con dolor crónico es, en principio, reversible. En consecuencia, no usamos instrumentos específicos para investigar la función motora. Sin embargo, la reorganización de la corteza motora (funcional) en pacientes con síndromes de dolor está bien documentada [35], [36], [37], [38]. Además, la corteza motora es un objetivo en los abordajes terapéuticos en pacientes con dolor crónico médicamente intratable que usan estimulación cerebral directa [39], [40], estimulación transcraneal de corriente directa [41] y estimulación magnética transcraneal repetitiva [42], [43]. Los mecanismos exactos de dicha modulación (facilitación frente a inhibición, o simplemente interferencia en las redes relacionadas con el dolor) aún no se han dilucidado [40]. Un estudio reciente demostró que una experiencia motora específica puede alterar la estructura del cerebro [13]. La sinaptogénesis, la reorganización de las representaciones de movimiento y la angiogénesis en la corteza motora pueden ocurrir con demandas especiales de una tarea motora. Tsao et al. mostró reorganización en la corteza motora de pacientes con dolor lumbar crónico que parecen ser específicos del dolor de espalda [44] y Puri et al. observó una reducción en la materia gris del área motora suplementaria izquierda en pacientes con fibromialgia [45]. Nuestro estudio no fue diseñado para desenredar los diferentes factores que pueden cambiar el cerebro en el dolor crónico, pero interpretamos nuestros datos relativos a los cambios de la sustancia gris que no reflejan exclusivamente las consecuencias de la entrada nociceptiva constante. De hecho, un estudio reciente en pacientes con dolor neuropático señaló anormalidades en regiones del cerebro que abarcan la percepción emocional, autonómica y del dolor, lo que implica que juegan un papel crítico en el cuadro clínico global del dolor crónico [28].
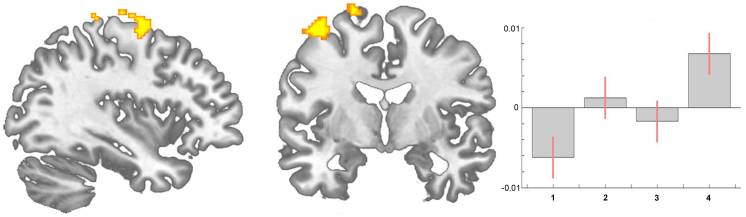
Figura 3: Mapas paramétricos estadísticos que demuestran un aumento significativo de materia gris cerebral en áreas motoras (área 6) en pacientes con coxartrosis antes en comparación con después de THR (análisis longitudinal, exploración I Estimaciones de contraste en x? =? 19, y? = ?? 12, z? =? 70.
Dos estudios piloto recientes se centraron en la terapia de reemplazo de cadera en pacientes con osteoartritis, el único síndrome de dolor crónico que es principalmente curable con reemplazo total de cadera [17], [46] y estos datos están flanqueados por un estudio reciente en pacientes con dolor lumbar crónico [ 47]. Estos estudios deben considerarse a la luz de varios estudios longitudinales que investigan la plasticidad neuronal dependiente de la experiencia en humanos a nivel estructural [30], [31] y un estudio reciente sobre cambios cerebrales estructurales en voluntarios sanos que experimentan estimulación dolorosa repetida [34] . El mensaje clave de todos estos estudios es que la diferencia principal en la estructura del cerebro entre los pacientes con dolor y los controles puede disminuir cuando el dolor se cura. Sin embargo, se debe tener en cuenta que simplemente no está claro si los cambios en los pacientes con dolor crónico se deben únicamente a la entrada nociceptiva o debido a las consecuencias del dolor o a ambos. Es más que probable que los cambios de comportamiento, como la privación o la mejora de contactos sociales, la agilidad, el entrenamiento físico y los cambios en el estilo de vida sean suficientes para dar forma al cerebro [6], [12], [28], [48]. Particularmente la depresión como una comorbilidad o consecuencia del dolor es un candidato clave para explicar las diferencias entre los pacientes y los controles. Un pequeño grupo de nuestros pacientes con OA mostró síntomas depresivos de leves a moderados que cambiaron con el tiempo. No encontramos las alteraciones estructurales del covagio significativamente con el puntaje BDI, pero surge la pregunta de cuántos otros cambios conductuales debido a la ausencia de dolor y la mejoría motora pueden contribuir a los resultados y en qué medida lo hacen. Estos cambios en el comportamiento pueden influir en la disminución de la sustancia gris en el dolor crónico y en el aumento de la sustancia gris cuando el dolor desaparece.
Otro factor importante que puede sesgar nuestra interpretación de los resultados es el hecho de que casi todos los pacientes con dolor crónico tomaron medicamentos contra el dolor, que suspendieron cuando no tenían dolor. Se podría argumentar que los AINE como el diclofenaco o el ibuprofeno tienen algunos efectos sobre los sistemas neuronales y lo mismo es cierto para los opioides, los antiepilépticos y los antidepresivos, medicamentos que se utilizan con frecuencia en la terapia del dolor crónico. El impacto de los analgésicos y otros medicamentos sobre los hallazgos morfométricos puede ser importante (48). Hasta el momento, ningún estudio ha mostrado efectos de la medicación analgésica sobre la morfología cerebral, pero varios estudios encontraron que los cambios en la estructura cerebral en pacientes con dolor crónico no se explican únicamente por la inactividad relacionada con el dolor [15], ni por el medicamento para el dolor [7], [9] [49]. Sin embargo, faltan estudios específicos. La investigación adicional debe enfocar los cambios dependientes de la experiencia en la plasticidad cortical, que puede tener implicaciones clínicas vastas para el tratamiento del dolor crónico.
También encontramos disminuciones de materia gris en el análisis longitudinal, posiblemente debido a procesos de reorganización que acompañan los cambios en la función motora y la percepción del dolor. Hay poca información disponible acerca de los cambios longitudinales en la materia gris del cerebro en condiciones de dolor, por esta razón no tenemos ninguna hipótesis sobre la disminución de la materia gris en estas áreas después de la operación. Teutsch et al. [25] encontró un aumento de la materia gris del cerebro en la corteza somatosensorial y de la mediación en voluntarios sanos que experimentaron estimulación dolorosa en un protocolo diario durante ocho días consecutivos. El hallazgo de materia gris aumenta después de la entrada nociceptiva experimental superpuesta anatómicamente hasta cierto punto con la disminución de la sustancia gris cerebral en este estudio en pacientes que fueron curados de dolor crónico de larga duración. Esto implica que la aportación nociceptiva en voluntarios sanos conduce a cambios estructurales dependientes del ejercicio, como posiblemente ocurre en pacientes con dolor crónico, y que estos cambios se invierten en voluntarios sanos cuando se detiene el aporte nociceptivo. En consecuencia, la disminución de la sustancia gris en estas áreas observada en pacientes con OA podría interpretarse como el mismo proceso fundamental: el ejercicio depende de los cambios cerebrales [50]. Como procedimiento no invasivo, MR Morphometry es la herramienta ideal para buscar los sustratos morfológicos de las enfermedades, profundizar nuestra comprensión de la relación entre la estructura y la función del cerebro, e incluso monitorear las intervenciones terapéuticas. Uno de los grandes desafíos en el futuro es adaptar esta poderosa herramienta para ensayos multicéntricos y terapéuticos de dolor crónico.
Limitaciones de este estudio
Aunque este estudio es una extensión de nuestro estudio anterior que amplía los datos de seguimiento a 12 meses e investiga a más pacientes, nuestro hallazgo principal de que los cambios morfométricos del cerebro en el dolor crónico son reversibles es bastante sutil. Los tamaños del efecto son pequeños (ver arriba) y los efectos son impulsados en parte por una reducción adicional del volumen de materia gris del cerebro regional en el punto temporal del escaneo 2. Cuando excluimos los datos del escaneo 2 (directamente después de la operación), solo es significativo los aumentos en la materia gris del cerebro para la corteza motora y la corteza frontal sobreviven a un umbral de p <0.001 sin corregir (Tabla 3).
Conclusión
No es posible distinguir hasta qué punto las alteraciones estructurales que observamos se deben a cambios en la entrada nociceptiva, cambios en la función motora o el consumo de medicamentos o cambios en el bienestar como tales. Enmascarar los contrastes grupales del primer y último escaneo revelaron diferencias mucho menores de lo esperado. Presumiblemente, las alteraciones cerebrales debidas a dolor crónico con todas las consecuencias se desarrollan a lo largo de un curso de tiempo bastante largo y también pueden necesitar algún tiempo para revertirse. Sin embargo, estos resultados revelan procesos de reorganización, que sugieren fuertemente que la entrada nociceptiva crónica y el deterioro motor en estos pacientes conducen a un procesamiento alterado en las regiones corticales y, en consecuencia, a cambios cerebrales estructurales que, en principio, son reversibles.
AGRADECIMIENTOS
Agradecemos a todos los voluntarios por la participación en este estudio y al grupo de Física y Métodos en NeuroImage Nord en Hamburgo. El estudio recibió la aprobación ética del comité de Ética local y se obtuvo el consentimiento informado por escrito de todos los participantes del estudio antes del examen.
Declaración de financiación
Este trabajo fue apoyado por subvenciones de la DFG (Fundación de Investigación Alemana) (MA 1862 / 2-3) y BMBF (Ministerio Federal de Educación e Investigación) (371 57 01 y NeuroImage Nord). Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
El sistema endocannabinoide: el sistema esencial del que nunca ha oído hablar
En caso de que no haya oído hablar del sistema endocannabinoide o ECS, no hay necesidad de sentirse avergonzado. De vuelta en el 1960, los investigadores que se interesaron en la bioactividad del Cannabis finalmente aislaron muchos de sus químicos activos. Sin embargo, tomó otros 30 años para que los investigadores que estudian modelos animales encuentren un receptor para estos químicos ECS en los cerebros de los roedores, un descubrimiento que abrió un mundo entero de investigación sobre la existencia de receptores ECS y cuál es su propósito fisiológico.
Ahora sabemos que la mayoría de los animales, desde peces hasta aves y mamíferos, poseen un endocannabinoide, y sabemos que los humanos no solo fabrican sus propios cannabinoides que interactúan con este sistema en particular, sino que también producimos otros compuestos que interactúan con el ECS, los de que se observan en muchas plantas y alimentos diferentes, mucho más allá de las especies de Cannabis.
Como sistema del cuerpo humano, el ECS no es una plataforma estructural aislada como el sistema nervioso o el sistema cardiovascular. En cambio, el ECS es un conjunto de receptores ampliamente distribuidos en todo el cuerpo que se activan a través de un conjunto de ligandos que colectivamente conocemos como endocannabinoides o cannabinoides endógenos. Ambos receptores verificados simplemente se llaman CB1 y CB2, aunque hay otros que se propusieron. Los canales PPAR y TRP también median algunas funciones. Del mismo modo, encontrará solo dos endocannabinoides bien documentados: anadamida y 2-arachidonoil glicerol, o 2-AG.
Además, las enzimas que sintetizan y degradan los endocannabinoides son fundamentales para el sistema endocannabinoide. Se cree que los endocannabinoides se sintetizan según una base necesaria. Las principales enzimas involucradas son la diacilglicerol lipasa y la N-acil-fosfatidiletanolamina-fosfolipasa D, que respectivamente sintetizan 2-AG y anandamida. Las dos principales enzimas de degradación son la amida hidrolasa de ácidos grasos, o FAAH, que descompone la anandamida y la monoacilglicerol lipasa, o MAGL, que descompone 2-AG. La regulación de estas dos enzimas puede aumentar o disminuir la modulación del ECS.
¿Cuál es la función del ECS?
El ECS es el principal sistema regulador homeostático del cuerpo. Se puede ver fácilmente como el sistema adaptogénico interno del cuerpo, siempre trabajando para mantener el equilibrio de una variedad de funciones. Los endocannabinoides funcionan ampliamente como neuromoduladores y, como tales, regulan una amplia gama de procesos corporales, desde la fertilidad hasta el dolor. Algunas de las funciones más conocidas del ECS son las siguientes:
Sistema nervioso
Desde el sistema nervioso central o el SNC, la estimulación general de los receptores CB1 inhibirá la liberación de glutamato y GABA. En el SNC, el ECS desempeña un papel en la formación y el aprendizaje de la memoria, promueve la neurogénesis en el hipocampo y también regula la excitabilidad neuronal. El ECS también juega un papel en la forma en que el cerebro reaccionará a las lesiones y la inflamación. Desde la médula espinal, el ECS modula la señalización del dolor y aumenta la analgesia natural. En el sistema nervioso periférico, en el cual los receptores CB2 controlan, el ECS actúa principalmente en el sistema nervioso simpático para regular las funciones de los tractos intestinal, urinario y reproductivo.
Estrés y estado de ánimo
El ECS tiene múltiples impactos sobre las reacciones al estrés y la regulación emocional, como el inicio de esta respuesta corporal al estrés agudo y la adaptación a través del tiempo a emociones a más largo plazo, como el miedo y la ansiedad. Un sistema endocannabinoide de trabajo saludable es fundamental para la forma en que los humanos modulan entre un grado satisfactorio de activación en comparación con un nivel que es excesivo y desagradable. El ECS también juega un papel en la formación de la memoria y posiblemente especialmente en la forma en que el cerebro imprime los recuerdos del estrés o la lesión. Debido a que el ECS modula la liberación de dopamina, noradrenalina, serotonina y cortisol, también puede influir ampliamente en la respuesta emocional y el comportamiento.
Sistema digestivo
El tracto digestivo está lleno de receptores CB1 y CB2 que regulan varios aspectos importantes de la salud gastrointestinal. Se cree que el ECS podría ser el "eslabón perdido" al describir el vínculo intestino-cerebro-inmune que juega un papel importante en la salud funcional del tracto digestivo. El ECS es un regulador de la inmunidad intestinal, tal vez al limitar el sistema inmune de la destrucción de la flora saludable, y también a través de la modulación de la señalización de citocinas. El ECS modula la respuesta inflamatoria natural en el tracto digestivo, lo que tiene implicaciones importantes para una amplia gama de problemas de salud. La motilidad gastrointestinal gástrica y general también parece estar parcialmente gobernada por el ECS.
Apetito y Metabolismo
El ECS, en particular los receptores CB1, desempeña un papel en el apetito, el metabolismo y la regulación de la grasa corporal. La estimulación de los receptores CB1 aumenta el comportamiento de búsqueda de alimentos, mejora la conciencia del olfato y también regula el equilibrio energético. Tanto los animales como los humanos que tienen sobrepeso tienen una desregulación ECS que puede llevar a este sistema a ser hiperactivo, lo que contribuye tanto a comer en exceso como a reducir el gasto de energía. Se ha demostrado que los niveles circulantes de anandamida y 2-AG son elevados en la obesidad, lo que podría deberse en parte a la disminución de la producción de la enzima degradadora de FAAH.
Salud Inmune y Respuesta Inflamatoria
Las células y los órganos del sistema inmune son ricos en receptores endocannabinoides. Los receptores cannabinoides se expresan en el timo, el bazo, las amígdalas y la médula ósea, así como en los linfocitos T y B, los macrófagos, los mastocitos, los neutrófilos y las células asesinas naturales. El ECS se considera el principal impulsor del equilibrio y la homeostasis del sistema inmune. Aunque no se entienden todas las funciones del ECS del sistema inmune, el ECS parece regular la producción de citocinas y también tiene un papel en la prevención de la hiperactividad en el sistema inmune. La inflamación es una parte natural de la respuesta inmune, y juega un papel muy normal en los insultos agudos al cuerpo, incluyendo lesiones y enfermedades; no obstante, cuando no se mantiene bajo control, puede volverse crónica y contribuir a una cascada de problemas de salud adversos, como el dolor crónico. Al mantener la respuesta inmune bajo control, el ECS ayuda a mantener una respuesta inflamatoria más equilibrada a través del cuerpo.
Otras áreas de salud reguladas por el ECS:
- La salud ósea
- Fertilidad
- Salud de la piel
- Salud arterial y respiratoria
- Sueño y ritmo circadiano
La mejor forma de apoyar un ECS saludable es una pregunta que muchos investigadores están tratando de responder. Estén atentos para más información sobre este tema emergente.
En conclusión,El dolor crónico se ha asociado con cambios cerebrales, incluida la reducción de la materia gris. Sin embargo, el artículo anterior demostró que el dolor crónico puede alterar la estructura y función general del cerebro. Aunque el dolor crónico puede provocar estos, entre otros problemas de salud, el tratamiento adecuado de los síntomas subyacentes del paciente puede revertir los cambios cerebrales y regular la materia gris. Además, han surgido más y más estudios de investigación detrás de la importancia del sistema endocannabinoide y su función para controlar y manejar el dolor crónico y otros problemas de salud. Información a la que se hace referencia del Centro Nacional de Información Biotecnológica (NCBI) . El alcance de nuestra información se limita a la quiropráctica, así como a las lesiones y afecciones de la columna vertebral. Para discutir el tema, no dude en preguntarle al Dr. Jiménez o contáctenos en 915-850-0900 .
Comisariada por el Dr. Alex Jiménez
Temas adicionales: Dolor de espalda
El dolor de espalda es una de las causas más frecuentes de discapacidad y días perdidos en el trabajo en todo el mundo. Como cuestión de hecho, el dolor de espalda se ha atribuido como la segunda razón más común para las visitas al consultorio médico, superado en número solo por las infecciones de las vías respiratorias superiores. Aproximadamente el 80% de la población experimentará algún tipo de dolor de espalda al menos una vez a lo largo de su vida. La columna vertebral es una estructura compleja compuesta por huesos, articulaciones, ligamentos y músculos, entre otros tejidos blandos. Debido a esto, lesiones y / o condiciones agravadas, como hernias discales, eventualmente puede conducir a síntomas de dolor de espalda. Las lesiones deportivas o las lesiones por accidentes automovilísticos suelen ser la causa más frecuente de dolor de espalda; sin embargo, a veces los movimientos más simples pueden tener resultados dolorosos. Afortunadamente, las opciones de tratamiento alternativo, como la atención quiropráctica, pueden ayudar a aliviar el dolor de espalda mediante el uso de ajustes espinales y manipulaciones manuales, mejorando finalmente el alivio del dolor.

TEMA EXTRA IMPORTANTE: Manejo del dolor lumbar
MÁS TEMAS: EXTRA EXTRA: Dolor crónico y tratamientos
Blanco
Referencias
Acordeón cercano
Alcance de la práctica profesional *
La información aquí contenida en "Cambios cerebrales asociados con el dolor crónico" no pretende reemplazar una relación personal con un profesional de la salud calificado o un médico con licencia y no es un consejo médico. Lo alentamos a que tome decisiones de atención médica basadas en su investigación y asociación con un profesional de la salud calificado.
Información del blog y debates sobre el alcance
Nuestro alcance informativo se limita a la quiropráctica, musculoesquelética, medicina física, bienestar, contribuyendo etiológico alteraciones viscerosomáticas dentro de las presentaciones clínicas, la dinámica clínica del reflejo somatovisceral asociado, los complejos de subluxación, los problemas de salud delicados y/o los artículos, temas y debates de medicina funcional.
Brindamos y presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista se rige por su ámbito de práctica profesional y su jurisdicción de licencia. Utilizamos protocolos funcionales de salud y bienestar para tratar y apoyar la atención de lesiones o trastornos del sistema musculoesquelético.
Nuestros videos, publicaciones, temas, asuntos e ideas cubren cuestiones clínicas, problemas y temas que se relacionan y respaldan directa o indirectamente nuestro ámbito de práctica clínica.*
Nuestra oficina ha intentado razonablemente proporcionar citas de apoyo y ha identificado el estudio o los estudios de investigación relevantes que respaldan nuestras publicaciones. Proporcionamos copias de los estudios de investigación de respaldo disponibles para las juntas reguladoras y el público a pedido.
Entendemos que cubrimos asuntos que requieren una explicación adicional de cómo puede ayudar en un plan de atención o protocolo de tratamiento en particular; por lo tanto, para discutir más a fondo el tema anterior, no dude en preguntar Dr. Alex Jiménez, DC, o póngase en contacto con nosotros en 915-850-0900.
Estamos aquí para ayudarlo a usted y a su familia.
Bendiciones
El Dr. Alex Jimenez corriente continua MSACP, enfermero*, CCCT, IFMCP*, CIFM*, ATN*
email: coach@elpasomedicinafuncional.com
Licenciado como Doctor en Quiropráctica (DC) en Texas & New Mexico*
Número de licencia de Texas DC TX5807, Nuevo México DC Número de licencia NM-DC2182
Licenciada como enfermera registrada (RN*) in Florida
Licencia de Florida Licencia de RN # RN9617241 (Control No. 3558029)
Estado compacto: Licencia multiestatal: Autorizado para ejercer en 40 Estados*
Dr. Alex Jiménez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mi tarjeta de presentación digital